Datation par le carbone 14
La datation par le carbone 14, dite également datation par le radiocarbone ou datation par comptage du carbone 14 résiduel, est une méthode de datation radiométrique fondée sur la mesure de l'activité radiologique du carbone 14 (14C) contenu dans la matière organique dont on souhaite connaître l'âge absolu, c'est-à-dire le temps écoulé depuis la mort de l'organisme (animal ou végétal) qui le constitue.
Le domaine d'utilisation de cette méthode correspond à des âges absolus de quelques centaines d'années jusqu'à, et au plus, 50 000 ans[1]. L'application de cette méthode à des événements anciens, tout particulièrement lorsque leur âge dépasse 6 000 ans (préhistoriques), a permis de les dater beaucoup plus précisément qu'auparavant. Elle a ainsi apporté un progrès significatif en archéologie et en paléoanthropologie.
Sommaire
1 Historique
2 Principe
3 Origine du radiocarbone naturel
4 Mesure de l'âge d'un échantillon de matière organique
4.1 Période radioactive conventionnelle
4.2 Courbes d'étalonnage
4.3 Autres corrections
5 Limites de la datation par le carbone 14
6 Notes et références
7 Voir aussi
7.1 Articles connexes
7.2 Liens externes
Historique |
En 1950, Willard Frank Libby réalise la première datation au carbone 14. L'appellation BP (Before Present) prend alors tout son sens : c'est l'histoire avant 1950.
En 1960, il reçoit le prix Nobel de chimie pour le développement de cette méthode (cf. article sur le chercheur pour l'histoire de cette découverte).
Principe |
Le carbone 14 ou radiocarbone est un isotope radioactif du carbone dont la période radioactive (ou demi-vie) est égale à 5 734 ± 40 ans selon des calculs relevant de la physique des particules datant de 1961. Cependant, pour les datations on continue par convention d'employer la valeur évaluée en 1951, de 5 568 ± 30 ans[2].
En première approche, on peut considérer que tant qu'une plante ou un animal est vivant, son organisme échange du carbone avec son environnement si bien que le carbone qu'il contient aura la même proportion de 14C (carbone 14) que dans la biosphère. Lorsque l'organisme meurt, il ne reçoit plus de 14C et celui qu'il contient va se désintégrer peu à peu. En deuxième approche, on considère qu'à cause du fractionnement isotopique survenant lors de la photosynthèse, le rapport isotopique 14C/12C de l'organisme est inférieur de quelques pour cents à celui de la biosphère. Durant sa vie, la proportion de 14C présent dans l'organisme par rapport au carbone total (12C, 13C et 14C) est donc aisément rapportable à celle existant dans l'atmosphère du moment.
La datation par le carbone 14 se fonde ainsi sur la présence dans tout organisme de radiocarbone en infime proportion (de l'ordre de 10−12 pour le rapport 14C/Ctotal). À partir de l'instant où un organisme meurt, la quantité de radiocarbone qu'il contient ainsi que son activité radiologique décroissent au cours du temps selon une loi exponentielle. Un échantillon de matière organique issu de cet organisme peut donc être daté en mesurant soit le rapport 14C/Ctotal avec un spectromètre de masse, soit son activité X années après la mort de l'organisme.
Origine du radiocarbone naturel |
Le radiocarbone naturel circule dans trois réservoirs : l'atmosphère, les océans et la biosphère.
Avec une période radioactive de 5 730 ans, le radiocarbone aurait depuis longtemps disparu de la biosphère s’il n’était produit en permanence.
Dans la haute atmosphère, des réactions nucléaires initiées par le rayonnement cosmique (spallation) produisent un flux de neutrons libres. Après avoir été ralentis par collision avec les molécules de l'air, les neutrons dans une certaine gamme d'énergie cinétique réagissent avec l'azote pour former du radiocarbone, selon l'équation bilan :
- 01n+714N→614C+11H{displaystyle _{0}^{1}mathrm {n} +_{7}^{14}!mathrm {N} rightarrow _{6}^{14}!mathrm {C} +_{1}^{1}!mathrm {H} }
Cette réaction est privilégiée du fait que l’azote constitue 78,11 % de l’atmosphère de la Terre. C'est entre 15 000 et 18 000 mètres, à des latitudes géomagnétiques élevées, que la production de radiocarbone a principalement lieu[3].
L'atome de radiocarbone ainsi produit réagit rapidement avec l'oxygène pour former du dioxyde de carbone.
Ce gaz circule dans toute l'atmosphère et se dissout dans les océans pour former des carbonates. Du radiocarbone circule donc aussi dans les océans.
Le dioxyde de carbone réagit également avec la biosphère. Les plantes assimilent ainsi du radiocarbone dans l'atmosphère par photosynthèse et elles sont mangées par les animaux. Les organismes marins assimilent également le radiocarbone présent dans les océans. Le radiocarbone se répand donc dans la biosphère tout au long de la chaîne alimentaire.
Le rapport 14C/Ctotal est considéré comme uniforme dans l'atmosphère, la surface des océans et la biosphère en raison des échanges permanents entre les organismes vivants et leur milieu.
De plus, on suppose que le flux de rayons cosmiques est constant sur une longue période de temps (première approximation). Par conséquent, le taux de production du radiocarbone est constant, donc le rapport 14C/Ctotal dans l’atmosphère, la surface des océans et la biosphère est constant (le nombre d’atomes produits égale le nombre d’atomes qui se désintègrent).
À la mort d'un organisme, tout échange avec le milieu extérieur cesse mais le radiocarbone initialement présent reste « piégé » et sa quantité se met à décroître exponentiellement selon le processus de la décroissance radioactive, ce qui permet de savoir depuis combien de temps l'organisme est mort.
Mesure de l'âge d'un échantillon de matière organique |
La désintégration radioactive du carbone 14 obéit à une loi de décroissance exponentielle caractérisée par sa demi-vie. Dater un échantillon de matière organique consiste à mesurer le rapport 14C/Ctotal (ce qu'il reste de radiocarbone naturel à la suite de la désintégration) et à en déduire son âge. Le rapport 14C/Ctotal est mesuré soit indirectement par la mesure de l'activité spécifique (nombre de désintégrations par unité de temps et par unité de masse de carbone) due au radiocarbone naturel qui est proportionnelle au rapport 14C/Ctotal, soit directement par spectrométrie de masse.
Quand elle fut mise au point par Libby à la fin des années 1940, la datation par le carbone 14 passait par la mesure de la radioactivité des échantillons ce qui était délicat du fait de la faiblesse du signal (il y a peu d’atomes de radiocarbone dans l’échantillon analysé, surtout après quelques milliers d’années, et encore moins qui se désintègrent) et du bruit de fond (radioactivité naturelle, rayons cosmiques, etc.).
Aujourd’hui, la mesure directe du rapport 14C/Ctotal par spectrométrie de masse est privilégiée car elle permet de dater des échantillons beaucoup plus petits (moins d’un milligramme contre plusieurs grammes de carbone auparavant) et beaucoup plus vite (en moins d’une heure contre plusieurs jours ou semaines). Le carbone extrait de l'échantillon est d'abord transformé en graphite, puis en ions qui sont accélérés par la tension générée par un spectromètre de masse couplé à un accélérateur de particules. Les différents isotopes du carbone sont séparés grâce au champ magnétique généré par un aimant, ce qui permet de compter les ions de carbone 14.
Les échantillons vieux de plus de 50 000 ans ne peuvent être datés au carbone 14, car le rapport 14C/Ctotal est trop faible pour être mesuré par les techniques actuelles ; les résultats ne sont relativement précis que pour les âges inférieurs à 35 000 ans.
La méthode la plus courante de datation consiste à déterminer la concentration Ct{displaystyle {C}_{t}}

t−t0=1λ×lnC0Ct{displaystyle {t}-{{t}_{0}}={frac {1}{lambda }}times ln {frac {{C}_{0}}{{C}_{t}}}}





Période radioactive conventionnelle |
L'âge carbone 14 conventionnel d'un échantillon de matière organique est calculé à partir d'une période conventionnelle de 5 568 ans, calculée en 1950 à partir d’une série de mesures. Depuis, des mesures plus précises ont été réalisées, et donnent une période de 5 730 ans, mais les laboratoires continuent à utiliser la valeur « conventionnelle » pour éviter les confusions.
Les résultats sont donnés en années « before present » (BP). Le point zéro (à partir duquel est mesuré le temps écoulé depuis la mort de l'organisme dont cette matière est issue) est fixé à 1950, en supposant un niveau de radiocarbone égal à celui de 1950. Depuis, le rejet de dioxyde de carbone provenant de combustibles fossiles (qui ne contiennent pratiquement plus de 14C) a modifié la signature isotopique de l'atmosphère.
Courbes d'étalonnage |
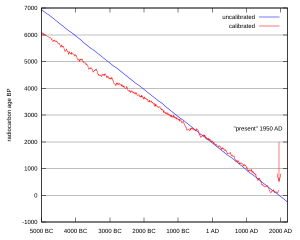
Étalonnage d'une datation au carbone 14.
Au début des années 1960, certaines divergences systématiques observées entre l'âge d'échantillons estimé par la datation par le carbone 14 et par l'archéologie ou la dendrochronologie posent problème.
Même si le flux de rayons cosmiques à l'origine de la formation du carbone 14 peut être supposé constant, la recherche spatiale a mis en évidence que la quantité de ce flux reçu dans la haute atmosphère terrestre variait à la suite des évolutions du champ magnétique terrestre et du champ magnétique solaire. Ceci explique que le taux de production du radiocarbone naturel ait varié au cours du temps.
Les changements climatiques ainsi que le rejet massif de carbone fossile dans l’atmosphère par l’industrie et les transports ont également modifié la quantité totale de carbone dans les trois réservoirs (atmosphère, océans et biosphère). Enfin, durant les années 1950 et 1960, on a pensé que les essais nucléaires étaient la cause du presque doublement de la quantité de radiocarbone dans l’atmosphère. Toutefois, ces phénomènes récents n'ont pas d'impact sur la datation d'objets anciens, dont le rapport 14C/C ne dépend que de leur âge, et du taux 14C/C à la date de leur arrêt d'activité biologique.
En conclusion, le rapport 14C/Ctotal dans la biosphère n'est pas constant dans le temps. Il est donc nécessaire de construire des courbes d'étalonnage en confrontant les datations obtenues grâce au carbone 14 et les datations par d’autres méthodes telles que la dendrochronologie.
Ces courbes permettent, connaissant « l'âge carbone 14 conventionnel » d’un échantillon, de trouver la date correspondante dans notre calendrier.
Autres corrections |
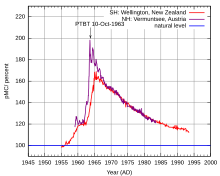
Influence des essais nucléaires sur la concentration atmosphérique en C-14.
Les essais nucléaires atmosphériques ont pratiquement doublé la concentration du C-14 dans l'atmosphère de l'hémisphère nord, avant que les niveaux ne se réduisent à la suite du traité d'interdiction partielle des essais nucléaires. Un mur construit en 1950 apparaîtra daté de l'an ~7000 AD pour des archéologues du futur.
Des corrections peuvent être appliquées si ce qui est mesuré (évènement radiocarbone) a un âge différent de ce qui doit être daté, par exemple par « pollution » par du carbone plus ancien ou plus récent. Certains phénomènes ne peuvent pas être corrigés (comme en archéologie les intrusions stratigraphiques ou les réutilisations de matériaux).
- Effet « réservoir marin » (Marine Reservoir effect)
- L'intégration du carbone atmosphérique par les eaux marines demande un certain délai et la circulation océanique globale est un cycle qui comprend des courants profonds dont la remontée apporte à la surface des eaux « vieilles » de plusieurs centaines d'années. Ces phénomènes impliquent que le carbone des eaux océaniques est en moyenne plus vieux de quatre cents ans que celui de l'atmosphère (effet réservoir global), avec de fortes variations géographiques. Cet effet est particulièrement problématique pour les archéologues qui cherchent à dater des ossements humains dont une partie de l'alimentation est d'origine marine.
- Effet « réservoir fluvial ou lacustre » (Lacustrine or River Réservoir effect)
- Chaque bassin hydrographique possède une dynamique du carbone qui lui est propre avec des possibilités d'enrichissement en carbone ancien issu des phénomènes pédogénétiques ou de la dissolution des roches.
- Effet « vieux bois » (Old Wood effect)
- Une mesure sur un charbon de bois date l'âge du bois. Si le charbon provient du cœur de l'arbre (duramen), il date l'âge de formation du cœur qui peut être beaucoup plus ancien que la date de la mort de l'arbre. Aujourd'hui, les archéologues évitent de faire des datations sur des charbons de bois provenant d'arbres à grande longévité.
- Effet « vieille coquille » (Old Shell effect)
- Effet connu des archéologues travaillant dans les régions côtières, qui ont à dater des artefacts façonnés dans des coquilles pouvant être plus anciennes que l'occupation archéologique.
- Effet « eau dure » (Hard Water effect)
- La dissolution de roches (en particulier les roches carbonatées) peut localement enrichir les milieux en carbone ancien. Cet effet est particulièrement sensible dans les milieux fermés (lacs, lagons, rivières).
- Effet « eau douce » (Fresh Water effect)
- La pluie ou les rivières peuvent localement enrichir en carbone récent certains milieux marins plus ou moins fermés et venir contrebalancer l'effet réservoir marin.
- Effet « volcanisme »
- Sur les flancs de volcans, l'émission de fumerolles peut enrichir localement l'atmosphère en carbone ancien.
- Effet « Suess » ou « émission carbone »
- Les véhicules équipés de moteurs à combustion interne utilisent des produits pétroliers qui ne contiennent que des isotopes stables du carbone, 12C et 13C, la totalité du 14C ayant disparu au cours de la longue durée d'enfouissement des combustibles fossiles. La végétation le long des autoroutes et axes de grande circulation automobile présente un marquage négatif : le gaz carbonique métabolisé par cette végétation provenant majoritairement de combustibles fossiles, dont le carbone 14 a disparu après quelques centaines de milliers d'années ; en conséquence, l'équilibre isotopique qui y est relevé peut conduire à des datations de plusieurs milliers d'années, pour des plantes pourtant encore sur pied.
- Ainsi, la datation par le 14C d'un arbuste poussant en bordure des autoroutes pourra fréquemment lui attribuer un « âge conventionnel » de douze mille ans ou plus. Des tables de correction existent donc pour permettre des datations liées à la révolution industrielle, en fonction des lieux d'émission de gaz carbonés dépourvus en 14C, issus de combustibles fossiles.
- Effet « post-bombe »
- Les essais nucléaires atmosphériques ont considérablement enrichi l'atmosphère en 14C. Depuis l'arrêt de ces essais, la décroissance atmosphérique en 14C est très régulière, ce qui permet des datations plus précises pratiquées pour les expertises de vins ou de denrées alimentaires.
- Certains processus impliquent un fractionnement isotopique du carbone, c'est-à-dire que l'on observe un enrichissement ou un appauvrissement en 14C par rapport à son abondance naturelle. Ainsi une plante effectuant la photosynthèse par le cycle C-4 n'aura pas la même proportion initiale de 14C qu'une plante suivant le cycle C-3[4].
Limites de la datation par le carbone 14 |
La datation par le carbone 14 est une méthode très utilisée par les archéologues, mais son utilisation présente quelques limites :
- c'est la date de mort de la plante ou de l'animal qui a servi de matière première qui est mesurée, pas celle de la construction ou de l'utilisation ou de la modification de l'objet à dater ;
- l'élément que l'on veut dater doit avoir incorporé du carbone dans des proportions équivalentes à celles de l'atmosphère ; elle ne s'applique donc qu'aux matériaux organiques et en aucune façon aux produits minéraux ;
- la méthode s'appuie sur le principe d'actualisme et suppose que le rapport 14C/C est resté constant dans l'atmosphère depuis la mort de l'élément à dater jusqu'à aujourd'hui ; ce n'est pas tout à fait le cas et des corrections sont donc nécessaires (cf. ci-dessus) ;
- la fermeture du système de l'élément à dater est aussi indispensable ; s'il incorpore de nouveaux atomes de carbone après sa mort, le rapport 14C/C est bouleversé et le résultat ne sera pas fiable ;
- la quantité de carbone radioactif diminue de moitié tous les 5 730 ans, valeur conventionnelle de la période de cet élément ; donc, seuls des éléments datant de moins de 50 000 ans au maximum (soit environ huit périodes) présentant une quantité mesurable avec une précision assez bonne peuvent être datés ; de plus l'approximation croit en fonction de l'âge des matériaux et les résultats sont approximatifs au-delà de 35 000 ans ; pour des âges plus anciens, d'autres méthodes sont mises en œuvre comme la datation au potassium-argon ou la datation par le couple rubidium-strontium qui permettent de dater des roches, ou la thermoluminescence, qui permet de dater des roches ou des sédiments qui ont été brûlés.
Notes et références |
Pour certains auteurs, les résultats obtenus ne sont pas fiables au-delà de 40 000 ans BP[réf. nécessaire].
Courbe de décroissance exponentielle du 14C
D'où vient le carbone 14 ?
Étienne Roth (dir.), Bernard Poty (dir.), Georgette Délibrias et al. (préf. Jean Coulomb), Méthodes de datation par les phénomènes nucléaires naturels, Paris, Éditions Masson, coll. « CEA », 1985, 631 p. (ISBN 2-225-80674-8), chap. 15 (« Le carbone 14 »).
Voir aussi |
Articles connexes |
- Carbone 14
- Datation
- Dendrochronologie
- Exemples de datations au carbone 14 :
Grotte Chauvet ;
Homme de Piltdown ;
Linceul de Turin.
Liens externes |
- Centre de datation par le carbone 14 (informations complètes sur la méthode)
- Datations radiométriques
(en) Online Radiocarbon Calibration
- Définition : Datation par le carbone 14
- La radioactivité du noyau carbone 14
- Définition : Anthracologie
- Portail de la Préhistoire
- Portail de l’archéologie
- Portail de la physique
- Portail de la chimie
- Portail du temps
