Anidride solforica
.mw-parser-output .nota-disambigua{clear:both;margin-bottom:.5em;border:1px solid #CCC;padding-left:4px}.mw-parser-output .nota-disambigua i{vertical-align:middle}
| Anidride solforica | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossido di zolfo | |
| Nomi alternativi | |
| anidride solforica | |
| Caratteristiche generali | |
Formula bruta o molecolare | SO3 |
Massa molecolare (u) | 80,06 |
| Aspetto | solido cristallino incolore (forma α) |
| Numero CAS | |
| Numero EINECS | 231-197-3 |
| PubChem | 24682 |
| SMILES | O=S(=O)=O |
| Proprietà chimico-fisiche | |
Densità (g/cm3, in c.s.) | 1,97 (forma γ) |
Solubilità in acqua | reagisce |
| Temperatura di fusione | 62,2 °C (335,35 K) (forma α) |
| Temperatura di ebollizione | decompone a 50 °C (323,15 K) (forma α) |
Tensione di vapore (Pa) a 293,15 K | 37333 (forma γ) |
| Proprietà termochimiche | |
ΔfH0 (kJ·mol−1) | −397,77 |
S0m(J·K−1mol−1) | 256,77 |
C0p,m(J·K−1mol−1) | 24,02 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
    | |
| pericolo | |
| Frasi H | 271 - 314 - 330 - 350 |
| Consigli P | 201 - 220 - 260 - 280 - 284 - 305+351+338 [1] |
Il triossido di zolfo o anidride solforica è un composto chimico corrosivo che reagendo con acqua produce acido solforico, essendo la sua anidride. Esiste in tre forme: le forme α e β sono dei solidi in condizioni normale, mentre la forma γ è un liquido. Il triossido di zolfo gassoso presente nell'atmosfera rappresenta la causa primaria delle piogge acide.
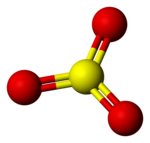
Dal punto di vista strutturale si tratta di una molecola trigonale planare (stato gassoso) ipervalente. Il doppio legame S=O misura 142 pm.
Indice
1 Forme strutturali
2 Proprietà chimiche
3 Sintesi e usi
4 Precauzioni e rischi
5 Note
6 Voci correlate
7 Altri progetti
8 Collegamenti esterni
Forme strutturali |

Modello a sfere e bastoncini di γ-SO3
La molecola γ-SO3 rappresenta un trimero ciclico con punto di fusione 16,8 °C. La forma α-SO3 è di aspetto fibroso e strutturalmente è un polimero alle cui estremità presenta gruppi OH. È un solido con punto di fusione 62,3 °C. La molecola β-SO3 è un solido dall'aspetto simile alla forma α, ma è un idrossi-polimero che fonde a 32,5 °C. Le forme β e γ hanno punto di ebollizione 44,45 °C, mentre la forma α decompone a 50 °C. β-SO3 e γ-SO3 sono instabili e tendono a convertirsi in α-SO3 per la presenza di tracce di acqua.[2]
Il riscaldamento dell'anidride solforica α fino al suo punto di fusione provoca un improvviso aumento della pressione di vapore in grado di generare quella che viene definita "esplosione alfa".
L'anidride solforica è fortemente igroscopica e il calore di idratazione sviluppato è in grado di infiammare materiali quali il legno e il cotone.[2]
Proprietà chimiche |
La reazione di formazione di una mole di anidride solforica (P = 1 atm, T = 298,15 K) a partire dagli elementi nei rispettivi stati standard è:
- S(s)+32O2(g)⟶SO3(g){displaystyle {ce {S(s) + 3/2O2 (g) -> SO3 (g)}}}
che condotta in una bomba calorimetrica (a volume costante), sviluppa 397 kJ per ogni mole di SO3 che si forma.
L'anidride solforica reagisce con l'acqua producendo acido solforico:
- SO3+H2O⟶H2SO4{displaystyle {ce {SO3 + H2O -> H2SO4}}}
con sviluppo di 87,895 kJ/mol. Alla temperatura di circa 340 °C si instaura un equilibrio in cui tutte e tre le specie sono presenti in concentrazioni significative.
Il triossido di zolfo reagisce col dicloruro di zolfo producendo l'importante reagente cloruro di tionile:
- SO3+SCl2⟶SOCl2+SO2{displaystyle {ce {SO3 + SCl2 -> SOCl2 + SO2}}}
L'equilibrio di dissociazione gassosa
- SO3(g)⟷SO2(g)+12O2(g){displaystyle {ce {SO3 (g) <-> SO2 (g) + 1/2 O2 (g)}}}
assume un ruolo di un certo rilievo termodinamico a temperature superiori a 779 °C.
Reagisce con i solfiti per dare tiosolfati.
Sintesi e usi |
A livello di laboratorio è possibile ottenere l'anidride solforica effettuando la pirolisi del bisolfato di sodio, processo che consta in due stadi in cui l'intermedio di reazione è il pirosolfato di sodio:
- a T = 315 °C,
2 NaHSO4 → Na2S2O7 + H2O
- a T = 460 °C,
Na2S2O7 → Na2SO4 + SO3
La sintesi industriale prevede invece l'ossidazione dell'anidride solforosa prodotta normalmente dalla combustione della pirite o dello zolfo, con ossigeno atmosferico a temperature comprese tra i 400-600 °C e in presenza dei catalizzatori pentossido di vanadio (V2O5) o platino.
Gli usi principali riguardano la sintesi dell'acido solforico e dell'oleum; nel primo caso il gas viene assorbito in torri contenenti una soluzione concentrata di acido solforico al 98-98,3% se si vuole ottenere acido solforico al 100% mentre nel secondo caso si è soliti utilizzare acido solforico puro. Il triossido di zolfo viene anche utilizzato come agente solfonante in particolare nell'industria dei coloranti.
In alternativa, è possibile sintetizzare l'anidride solforica in laboratorio attraverso il riscaldamento di una miscela di anidride fosforica e acido solforico, secondo il seguente equilibrio:
3 H2SO4 + P2O5 → 2 H3PO4 + 3 SO3
Il risultato sarà anidride solforica gassosa, che per l'utilizzo deve essere quindi condensata, e acido fosforico.
Precauzioni e rischi |
L'anidride solforica è un composto chimico molto pericoloso a causa della sua reattività.
Essa infatti fuma fortemente all'aria ed esercita un'energica azione disidratante su molte sostanze organiche, carbonizzandole.
Se inalata, può reagire con l'acqua delle mucose nasali e della saliva trasformandola in acido solforico (H330).
Può inoltre provocare il cancro (H350).
Note |
^ Sigma Aldrich; rev. del 13.01.2012
^ ab Merck Index of Chemicals and Drugs, 9th ed. monograph 8775
Voci correlate |
- Acido solforico
- Anidride solforosa
- Pirosolfato di sodio
Altri progetti |
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su anidride solforica
Wikimedia Commons contiene immagini o altri file su anidride solforica
Collegamenti esterni |
Anidride solforica, su thes.bncf.firenze.sbn.it, Biblioteca Nazionale Centrale di Firenze.
(EN) Anidride solforica, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Preparazione dell'anidride solforica, su itchiavari.org.



