Silicio
| Silicio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
alluminio ← Silicio → fosforo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Linea spettrale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | Silicio, Si, 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | semimetalli | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gruppo, periodo, blocco | 14 (IVA), 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 2 330 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Durezza | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 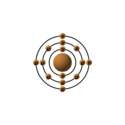 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 3P0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 28,0855 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Raggio atomico (calc.) | 110 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 110 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio di van der Waals | 210 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Ne]3s23p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
e− per livello energetico | 2, 8, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | ±2, 4 (anfotero), -4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | cubico a facce centrate con cavità tetraedrica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido (non magnetico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 1 687 K (1 413,85 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 3 173 K (2 899,85 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 12,06 × 10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 384,22 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 50,55 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 4,77 Pa a 1 683 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,90 (Scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 700 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 2,52 × 10−4 /m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 148 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 786,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 577,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 3 231,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 4 355,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quinta ionizzazione | 16 091 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di sesta ionizzazione | 19 805 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di settima ionizzazione | 23 780 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di ottava ionizzazione | 29 287 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di nona ionizzazione | 33 878 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di decima ionizzazione | 38 726 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il silicio è l'elemento chimico della tavola periodica degli elementi che ha come simbolo Si con valenza 2,4,6 e come numero atomico 14. È un semimetallo e un semiconduttore. È meno reattivo del suo analogo chimico, il carbonio. È il secondo elemento per abbondanza nella crosta terrestre dopo l'ossigeno, componendone il 27,7% del peso[1]. Si trova in argilla, feldspato, granito e quarzo, principalmente in forma di biossido di silicio, silicati e alluminosilicati (composti contenenti silicio, ossigeno e metalli). Il silicio è il componente principale di vetro, cemento, ceramica e silicone.
Indice
1 Storia
2 Caratteristiche
3 Disponibilità
4 Isotopi
5 Composti
6 Ruolo biologico
7 Produzione
8 Purificazione
8.1 Metodi fisici
8.2 Metodi chimici
9 Cristallizzazione
10 Applicazioni
10.1 Applicazioni dei composti del silicio
11 Precauzioni
12 La Silicon Valley
13 Silicio e silicone nelle traduzioni dall'inglese
14 Il silicio nella fantascienza
15 Note
16 Voci correlate
17 Altri progetti
18 Collegamenti esterni
Storia |
Il silicio (dal latino silex, silicis che significa selce) venne identificato per la prima volta da Antoine Lavoisier nel 1787, e venne successivamente scambiato per un composto da Humphry Davy nel 1800. Nel 1811 Gay Lussac e Thenard probabilmente prepararono del silicio amorfo impuro attraverso il riscaldamento di potassio con tetrafluoruro di silicio. Nel 1824 Berzelius preparò del silicio amorfo usando all'incirca lo stesso metodo di Lussac. Berzelius inoltre purificò il prodotto attraverso successivi lavaggi.
Caratteristiche |
Nella sua forma cristallina, il silicio ha un colore grigio e una lucentezza metallica, ma il suo colore può variare. Anche se è un elemento relativamente inerte, reagisce con gli alogeni e gli alcali diluiti, ma la maggior parte degli acidi (eccetto l'acido fluoridrico) non lo intaccano.
Il silicio trasmette più del 95% di tutte le lunghezze d'onda della luce infrarossa.
Il silicio è alla base di tutti i silicati, minerali formati da silicio e ossigeno più altri elementi in forma ionica. I silicati sono contenuti nei magmi e, per la struttura tetraedrica della silice, il magma diventa più viscoso, e capace di trattenere maggiori quantità di gas. In base al contenuto di silice si determina l'acidità di un magma e delle rocce dal quale deriva. Se è poco presente il magma si dirà basico.
Disponibilità |
Il silicio è il principale componente degli aeroliti, che sono una classe di meteoroidi nonché della tectite, che è una forma naturale di vetro.
Calcolando in base al peso, il silicio compone il 27,7% della crosta terrestre e dopo l'ossigeno è il secondo elemento più abbondante[1]. Il silicio elementare non si trova in natura, appare in genere come ossido (ametista, agata, quarzo, rocce cristalline, selce, diaspro, opale) e silicati (granito, amianto, feldspato, argilla, orneblenda, mica e altri).
Isotopi |
Il silicio ha nove isotopi, con numero di massa che varia tra 25 e 33. Il 28Si (l'isotopo più abbondante, con il 92,23%), il 29Si (4,67%), e il 30Si (3,1%) sono stabili; il 32Si è un isotopo radioattivo prodotto dal decadimento dell'argon. La sua emivita, dopo un lungo dibattito, è stata determinata in circa 276 anni, e decade per emissione beta in 32P (che ha emivita di 14,28 anni) e quindi in 32S.
Composti |

Struttura chimica della silice (diossido di silicio)
Esempi di composti del silicio sono il monossido di silicio (SiO), il diossido di silicio (SiO2), l'acido silicico (H4SiO4), i silicati, le ceramiche di silice come il carburo di silicio (SiC) e il nitruro di silicio (Si3N4), alogenuri di silicio come il tetracloruro di silicio (SiCl4) e il tetrafluoruro di silicio (SiF4), i siliconi.
Il silicio è inoltre in grado di formare composti in cui risalta la sua natura non metallica, i siliciuri, come il siliciuro di magnesio, che possono avere natura ionica o covalente polare a causa dell'elevata elettropositività dell'elemento.
Ruolo biologico |
Il silicio nei suoi composti inorganici come la silice è largamente diffuso nei viventi; può essere presente nei tessuti in forme differenti. Il ruolo principale noto è rappresentato dalla formazione di strutture di protezione e sostegno basate su composti inorganici come acido silicico e silice (biossido di silicio), in microorganismi, spugne, piante.
La silice è molto importante per la vita animale e vegetale. Le diatomee estraggono la silice dall'acqua per costruire i muri protettivi delle loro cellule; gli equiseti lo concentrano nel fusto della pianta usandolo per conferirgli robustezza e notevole resistenza alla masticazione, per scoraggiare gli erbivori.
Diatomee e radiolari, ad esempio, utilizzano principalmente silice, come base strutturale dell'impalcature cellulare, le spugne utilizzano la silice per spicole e altre strutture di sostegno, l'equiseto presenta diversi granuli di silice nell'epidermide esterna che lo rendono leggermente abrasivo (e indigesto ad alcuni erbivori), l'ortica presenta la punta dei peli urticanti silicizzata.
Nei metazoi composti del silicio sono stati ritrovati in concentrazioni maggiori nei tessuti connettivi e di sostegno (ossa, tunica esterna collagena delle arterie, cartilagini) e nelle regioni extracellulari cerebrali. L'organismo umano ne contiene in totale una quantità stimata sui 250 milligrammi. La presenza del silicio non si identifica con una funzione biochimica nota[2] e potrebbe essere di natura accidentale (accumulo nei tessuti con maggiore affinità per il composto); gli effetti clinici da carenza negli esseri umani non sono noti, mentre un eccesso di silicio può causare emolisi dei globuli rossi e causare alterazioni cellulari come conseguenza diretta[3]. La farmacopea sta esaminando eventuali utilizzi di composti organici del silicio per lo sviluppo di farmaci[4]
Sintomi da carenza non sono noti nei mammiferi, se non quelli indotti sperimentalmente, essendo il silicio pressoché ubiquitario (secondo elemento presente per abbondanza sulla crosta terrestre dopo l'ossigeno). Esistono vaste divulgazioni che incentiverebbero l'assunzione dei cosiddetti integratori a base di silicio organico (spesso preparati erboristici dove il silicio è invece presente sotto forma di silice inorganica da equiseto o ortica, da acidi silicici o da alchilsilanoli, questi ultimi composti propriamente organici) ipotizzando ruoli nella sintesi della idrossiprolina, coinvolta nella catena polimerica del collagene. L'attività dell'enzima a questa sintesi deputato, procollagene-prolina diossigenasi, è regolato invece dalla presenza di acido 2-chetoglutarico, ascorbato (cofattore nella riduzione), e ferro (Fe3+ ridotto a Fe2+)[5], e non da composti del silicio. Il silicio è comunque assorbito dall'organismo tramite l'ubiquitario ione inorganico ortosilicico.[6]
.mw-parser-output .chiarimento{background:#ffeaea;color:#444444}.mw-parser-output .chiarimento-apice{color:red}Il silicio è stato riconosciuto come un fattore di sviluppo negli animali giovani e nei bambini. A livello cutaneo, maggiormente presente negli strati connettivi profondi, è dotato di proprietà idratanti e acceleranti della cicatrizzazione delle ferite[senza fonte]. A livello osseo, è provato che supplementi alimentari di silicio organico (proveniente soprattutto da equiseto, avena ed ortica) possono accelerare la saldatura delle fratture, mentre a livello sanguigno esistono studi fornenti prove che i silicati organici possano indurre il differenziamento dei granulociti neutrofili e stimolare la fagocitosi. Studi preliminari indicherebbero come i silicati abbiano una certa influenza sul sistema endocrino generale umano.[senza fonte] I meccanismi di come ciò possa eventualmente verificarsi sono però sconosciuti.
L'erboristeria, comunque, non raccomanda una fitoterapia a base di piante troppo remineralizzanti (e in particolare ricche di silicio), quando sono presenti lesioni ossee di tipo degenerativo (ad esempio artrosi).
Approvvigionarsi silicati organici tramite la dieta non è tuttavia difficile. Il silicio è abbondante nell'acqua potabile, nelle cipolle, nei cavolfiori, nei fagioli, nei piselli, nelle mele e nelle fragole. Tra le piante comuni, ricche di silicati organici sono la polmonaria, l'equiseto, la piantaggine, l'arnica, l'ortica e la gramigna.
Produzione |
Il silicio viene preparato commercialmente tramite riscaldamento di silice ad elevato grado di purezza, in una fornace elettrica usando elettrodi di carbonio. A temperature superiori a 1 900 °C, il carbonio riduce la silice in silicio secondo l'equazione chimica
- SiO2+2C⟶Si+2CO{displaystyle {ce {SiO2 + 2C -> Si + 2CO}}}
Il silicio liquido si raccoglie in fondo alla fornace, e viene quindi prelevato e raffreddato. Il silicio prodotto tramite questo processo viene chiamato silicio di grado metallurgico (MGS) ed è puro al 98%.
Un eccesso di carbonio può portare alla formazione del carburo di silicio
- SiO2+C⟶SiO+CO{displaystyle {ce {SiO2 + C -> SiO + CO}}}
- SiO+2C⟶SiC+CO{displaystyle {ce {SiO + 2C -> SiC + CO}}}
Comunque, se la concentrazione di SiO2 è mantenuta elevata, il carburo di silicio può essere eliminato
- 2SiO2+SiC⟶3Si+2CO{displaystyle {ce {2SiO2 + SiC -> 3Si + 2CO}}}
Per raggiungere gradi di purezza superiori necessari ad esempio per realizzare dispositivi elettronici a semiconduttore, è necessario praticare un ulteriore purificazione ad esempio con il metodo Siemens. Nel 2016 il silicio di grado metallurgico costava circa 1,74 €/kg[7].
Purificazione |
L'uso del silicio nei semiconduttori richiede una purezza più elevata di quella fornita dal silicio di grado metallurgico. Storicamente sono stati usati un numero di metodi diversi per produrre silicio ad alta purezza.
Metodi fisici |

Barra monocristallina di Silicio
Le prime tecniche di purificazione del silicio erano basate sul fatto che quando il silicio viene fuso e risolidificato, l'ultima parte di silicio che solidifica contiene la maggior parte delle impurità. Il primissimo sistema di purificazione, descritto nel 1919 e usato su scala limitata per la fabbricazione di componenti dei radar durante la seconda guerra mondiale, richiedeva la polverizzazione del silicio di grado metallurgico e la sua parziale dissoluzione in acido. Quando veniva polverizzato, il silicio si spezzava in modo che le zone più deboli e ricche di impurità restassero all'esterno del risultante grano di silicio. Come risultato, il silicio ricco di impurità era il primo a disciogliersi quando trattato con l'acido, lasciando un prodotto più puro.
Nella fusione a zona, il primo metodo di purificazione del silicio ad essere utilizzato su scala industriale, sbarre di silicio di grado metallurgico venivano riscaldate partendo da una delle sue estremità, fino a quando questa iniziava a fondersi. Il riscaldatore quindi veniva lentamente spostato lungo la barra mantenendo una piccola porzione fusa mentre il silicio si raffreddava e risolidificava dietro di essa. Poiché la maggior parte delle impurità tendeva a rimanere nella parte fusa piuttosto che risolidificarsi, alla fine del processo queste si erano spostate nell'ultima parte della barra ad essere fusa. Questa estremità veniva quindi tagliata e gettata, ripetendo il processo se una purezza più elevata era necessaria.
Metodi chimici |
Oggigiorno il silicio viene purificato convertendolo in un composto che può essere purificato più facilmente del silicio stesso, e quindi convertito di nuovo in silicio puro. Il triclorosilano è il composto di silicio più comunemente usato in questo processo, anche se a volte si utilizzano anche il tetracloruro di silicio e il silano. Questi composti, liquidi o gassosi, vengono purificati per distillazione frazionata fino ad ottenere una miscela di composti di solo silicio. Dopodiché questi gas vengono soffiati sopra a del silicio ad alta temperatura e si decompongono, depositando silicio policristallino ad alta purezza.
Nel processo Siemens, sbarre di silicio ultrapuro sono esposte al triclorosilano a 1150 °C; il gas di triclorosilano si decompone e deposita dell'altro silicio sulla barra, allargandola secondo la reazione chimica
- 2HSiCl3⟶Si+2HCl+SiCl4{displaystyle {ce {2 HSiCl3 -> Si + 2 HCl + SiCl4}}}
Il silicio prodotto da questo e da processi simili viene chiamato silicio policristallino. Il silicio policristallino ha un livello di impurità pari a 1 parte per miliardo o inferiore.
Per un certo periodo, la DuPont produsse silicio ultrapuro facendo reagire il tetracloruro di silicio con vapori di zinco ad alta purezza a 950 °C, producendo silicio secondo la formula
- SiCl4+2Zn⟶Si+2ZnCl2{displaystyle {ce {SiCl4 + 2 Zn -> Si + 2 ZnCl2}}}
Questa tecnica era afflitta da problemi pratici (come il cloruro di zinco, un sottoprodotto, che si solidificava bloccando le linee) e venne abbandonata a favore del processo Siemens.
Cristallizzazione |
Il processo Czochralski viene usato per creare cristalli singoli di silicio di alta purezza. Il sistema isometrico è sinonimo di sistema cubico.
Esistono sette possibili sistemi cristallini, classificati in base alla
simmetria del reticolo:
Reticolo Simmetria
1) triclino -1
2) monoclino 2/m
3) ortorombico mmm
4) tetragonale 4/mmm
5) trigonale -3m
6) esagonale 6/mmm
7) cubico m-3m
La simmetria è data con il simbolo di Hermann-Mauguin. il simbolo -n (es. -1, -3) indica un asse di rotoinversione (-1 è il centro di inversione). Da notare che è possibile "centrare" in vario modo alcuni reticoli (ret. a facce centrate, a corpo centrato, a base centrata) in modo da ottenere, in totale, 14 reticoli (di Bravais). Per il cubico, la combinazione delle simmetrie (m: riflessione rispetto a un piano parallelo a (100); -3: rotazione di 120°, con inversione, attorno all'asse [111]; m: riflessione rispetto a un piano parallelo a (110)) impone una metrica di tipo "G=aI" dove "a" è la costante di cella e "I" la matrice identità. In pratica, poiché gli elementi di G sono i prodotti scalari dei vettori base del reticolo (g11 = a^2...), G=aI corrisponde a un reticolo cubico di "lato" a.
E' da notare che, dato un reticolo, è sempre possibile definire celle
elementari di varia forma e volume. Ciò che resta invariante è la simmetria
del reticolo.
Applicazioni |
Il silicio è un semiconduttore intrinseco (o puro) e può essere drogato con arsenico, fosforo, gallio o boro per renderlo più conduttivo e utilizzarlo in transistor, pannelli solari o celle solari, e altre apparecchiature a semiconduttori, che sono utilizzate in elettronica e altre applicazioni ad alta tecnologia. Esistono due tipi di drogaggio del silicio che permettono di dare eccesso di elettroni alla banda di conduzione (silicio di tipo n) o lacune di elettroni alla banda di valenza (silicio di tipo p).
Il silicio è inoltre un importante costituente di alcuni tipi di acciaio; il suo limite di concentrazione è del 5%, in quanto oltre si ha un notevole abbassamento della resilienza a causa del suo potenziale di accrescimento della grana cristallina. Rende inoltre possibile far separare grafite negli acciai anche già a partire da concentrazioni di carbonio maggiori di 0,50%. Si segnala la sua presenza (1-2%) negli acciai per molle, dove accresce il limite elastico, avvicinandolo a quello di rottura, e favorisce la temprabilità.

Transistor al silicio

Pannelli fotovoltaici in silicio monocristallino

Struttura al microscopio dell'acciaio al silicio
Applicazioni dei composti del silicio |
- Il diossido di silicio (o silice) in forma di sabbia e argilla è un importante ingrediente del cemento e dei mattoni.
- La silice della sabbia è un componente principale del vetro.
- Silice e silicati sono la base del materiale refrattario usato nella coibentazione per le produzioni ad alte temperature, e i silicati sono impiegati nella fabbricazione di smalti e terraglie.
- Il carburo di silicio, chiamato anche carborundum, è uno dei più importanti abrasivi.
- I siliconi sono composti flessibili contenenti legami silicio-ossigeno o silicio-carbonio; sono ampiamente usati in forma di gel per gomme, collanti, protesi mammarie, lenti a contatto e altro.
- Il silicio amorfo idrogenato si è mostrato promettente per la produzione di celle solari e apparati elettronici a basso costo.
Precauzioni |
Una grave malattia dei polmoni chiamata silicosi è molto frequente tra i minatori, i tagliatori di pietre e altri lavoratori che sono impegnati in lavori dove polvere di silicati viene inalata in grandi quantità.
La Silicon Valley |
Poiché il silicio è un importante elemento semiconduttore, il principale di tutta l'industria elettronica, la regione di Silicon Valley in California, nota per le numerose aziende di informatica ed elettronica, prende il suo nome da questo elemento (silicon in inglese).
Silicio e silicone nelle traduzioni dall'inglese |
Spesso i traduttori traducono la parola inglese silicon (che significa appunto silicio) con silicone, a causa della somiglianza dei due vocaboli. Mentre la traduzione di silicio è silicon (/ˈsɪlɪkən/), quella di silicone è silicone (/ˈsɪlɪkəʊn/).
Capita quindi spesso di trovare diciture come chip di silicone che derivano da questa errata traduzione. Nell'episodio Il mostro dell'oscurità del telefilm Star Trek si parla diffusamente di una specie vivente a base silicone al posto dell'originaria forma di vita a base silicio[8]. Nel film Wargames - Giochi di guerra del 1983 con Matthew Broderick, diretto da John Badham in una conversazione un generale statunitense dice, secondo l'errata traduzione, "ammasso di silicone" per definire un computer.
Nel film 007 - Bersaglio mobile un microchip al silicio viene identificato come microchip al silicone rivelando una scarsa attenzione della traduzione dall'inglese.
Anche in una puntata dei Simpson, il doctor Hibbert chiede a Homer se gli alieni che egli ha visto siano "a base di carbone oppure di silicone"; in questo caso l'errore è doppio: anche "carbon" viene tradotto erroneamente (avrebbe dovuto essere carbonio, dato che carbone in inglese è "coal").
Silicon è tradotto in Silicone anche nel romanzo Artemis - La prima città sulla luna di Andy Weir del 2017.[9]
Il silicio nella fantascienza |
Un tema che ricorre nel filone dell'arte di fantascienza è l'ipotesi dell'esistenza di forme di vita basate sul silicio invece che sul carbonio. Probabilmente il tema è da attribuirsi alla vicinanza dei due elementi nella tavola periodica e a discussioni filosofiche che si interrogano sul fatto che i computer e i robot (i cui microprocessori sono costruiti in silicio) possano essere pensati come delle particolari "forme di vita".
L'espediente della creatura basata sul silicio è spesso utilizzato per proporre il tema dell'alieno come "qualcosa che non può essere compreso", qualcosa di alternativo e incompatibile, talmente diverso da essere addirittura basato su elementi chimici differenti. La serie manga Blame! ad esempio sviluppa notevolmente il tema facendo degli esseri a base di silicio alcuni tra gli antagonisti principali con capacità fisiche estremamente sviluppate di quelle di un comune essere umano, forse ad ipotizzare la superiorità dell'elemento, rispetto al carbonio, nel generare forme di vita resistenti.
Note |
^ ab (EN) Elements, terrestrial abundance, su daviddarling.info.
^ Organosilicon Chemistry S. Pawlenko Walter de Gruyter New York, 1986
^ A. F. Holleman, E. Wiberg, N. Wiberg. Textbook of Inorganic Chemistry. Edition 101.. de Gruyter, Berlin 1995 ISBN 3-11-012641-9, S. 880
^ Bains, W.; Tacke, R. "Silicon chemistry as a novel source of chemical diversity in drug design" Curr Opin Drug Discov Devel. 2003 Jul;6(4):526-43.
^
(EN) L. De Jong, Stoicheiometry and kinetics of the prolyl 4-hydroxylase partial reaction, in Biochimica et Biophysica Acta, vol. 787, nº 1, 1984, pp. 105 - 111, DOI:10.1016/0167-4838(84)90113-4, PMID 6326839.
^ JJ, Hampson GN.Orthosilicic acid stimulates collagen type 1 synthesis and osteoblastic differentiation in human osteoblast-like cells in vitro. Bone. 2003 Feb;32(2):127-35
^ (EN) Average silicon prices in the United States from 2012 to 2016, by type (in U.S. cents per pound), su statista.com.
^ (EN) The Devil in the Dark, su hypertrek.org.
^ Andy Weir, Artemis - La prima città sulla Luna, traduzione di Marta Lanfranco, Roma, Newton Compton Editori, 2017, ISBN 978-88-227-1021-5.
Voci correlate |
- Silicio nativo
- Silicio monocristallino
- Silicio policristallino
- Silicio nanocristallino
- Silicene
Altri progetti |
Altri progetti
- Wikiquote
- Wikizionario
- Wikimedia Commons
 Wikiquote contiene citazioni di o su silicio
Wikiquote contiene citazioni di o su silicio
 Wikizionario contiene il lemma di dizionario «silicio»
Wikizionario contiene il lemma di dizionario «silicio»
 Wikimedia Commons contiene immagini o altri file su silicio
Wikimedia Commons contiene immagini o altri file su silicio
Collegamenti esterni |
Silicio, su thes.bncf.firenze.sbn.it, Biblioteca Nazionale Centrale di Firenze.
(EN) Silicio, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
.mw-parser-output .navbox{border:1px solid #aaa;clear:both;margin:auto;padding:2px;width:100%}.mw-parser-output .navbox th{padding-left:1em;padding-right:1em;text-align:center}.mw-parser-output .navbox>tbody>tr:first-child>th{background:#ccf;font-size:90%;width:100%}.mw-parser-output .navbox_navbar{float:left;margin:0;padding:0 10px 0 0;text-align:left;width:6em}.mw-parser-output .navbox_title{font-size:110%}.mw-parser-output .navbox_abovebelow{background:#ddf;font-size:90%;font-weight:normal}.mw-parser-output .navbox_group{background:#ddf;font-size:90%;padding:0 10px;white-space:nowrap}.mw-parser-output .navbox_list{font-size:90%;width:100%}.mw-parser-output .navbox_odd{background:#fdfdfd}.mw-parser-output .navbox_even{background:#f7f7f7}.mw-parser-output .navbox_center{text-align:center}.mw-parser-output .navbox .navbox_image{padding-left:7px;vertical-align:middle;width:0}.mw-parser-output .navbox+.navbox{margin-top:-1px}.mw-parser-output .navbox .mw-collapsible-toggle{font-weight:normal;text-align:right;width:7em}.mw-parser-output .subnavbox{margin:-3px;width:100%}.mw-parser-output .subnavbox_group{background:#ddf;padding:0 10px}
.mw-parser-output .CdA{border:1px solid #aaa;width:100%;margin:auto;font-size:90%;padding:2px}.mw-parser-output .CdA th{background-color:#ddddff;font-weight:bold;width:20%}
| Controllo di autorità | LCCN (EN) sh85122512 · GND (DE) 4077445-4 · BNF (FR) cb11976956v (data) |
|---|







