エタノール
| エタノール | |
|---|---|
 | |
 |  |
IUPAC名 エタノール | |
別称 エチルアルコール メチルカルビノール 酒精 | |
| 識別情報 | |
CAS登録番号 | 64-17-5 |
ChemSpider | 682 |
E番号 | E1510 (追加化合物) |
KEGG | C00469 |
RTECS番号 | KQ6300000 |
SMILES
| |
| 特性 | |
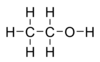
化学式 | C2H6O |
モル質量 | 46.07 g mol−1 |
示性式 | C2H5OH または CH3CH2OH |
| 外観 | 無色液体 |
密度 | 0.789 g/cm3 |
融点 | −114.14 °C, 159 K, -173 °F |
沸点 | 78.29 °C, 351 K, 173 °F |
水への溶解度 | 水と任意に混合 |
酸解離定数 pKa | 15.9 |
粘度 | 1.200 mPa s (cP) at 20.0 ℃ |
双極子モーメント | 5.64 fC fm (1.69 D) (gas) |
| 熱化学 | |
標準生成熱 ΔfH | -277.69 kJ mol-1[1] |
標準燃焼熱 ΔcH | 1367.6 J mol-1K-1 |
標準モルエントロピー S | 160.7 J mol-1K-1 |
標準定圧モル比熱, Cp | 111.46 J mol-1K-1 |
| 危険性 | |
安全データシート(外部リンク) | 日本アルコール産業株式会社 ICSC 0044 |
EU分類 | |
NFPA 704 |  3 1 0 |
Rフレーズ | R11 R20 R21 R22 R36 |
Sフレーズ | (S2) S7 S16 |
引火点 | 13 ℃ |
| 関連する物質 | |
| 関連物質 | メタノール プロパノール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
エタノール(ethanol)は、アルコールの一種。揮発性の無色液体で、特有の芳香を持つ[2]。よく知られた別名はエチルアルコール (ethyl alcohol)。酒を酒たらしめる化学成分であり、酒精(しゅせい)とも呼ばれる[2]。その分子は、油になじみやすいエチル基 CH3CH2- と水になじみやすいヒドロキシ基 -OH が結合した構造を持つ。
メチルアルコールなどの他のアルコールが知られる以前から広く用いられてきた物質であり、エチルアルコールを指して単に「アルコール」と呼ぶことも多い。例えば、アルコール発酵で生じるアルコールはエタノールであり、アルコール飲料に含まれるアルコールもエタノールである。変性アルコールは、飲用への転用を防ぐために、毒性の強いメタノールなどが添加されたエタノールである[3]。
発酵により生じたエタノールを蒸留・精製すると、純度が93パーセント[注釈 1]のエタノールが得られる。残りの7パーセントは水分である。この水分を適当な処理で取り除いて、エタノールの純度を99.5パーセント以上にまで高めたものを、無水エタノール(absolute ethanol または anhydrous ethanol)と称する。
酸化によってアセトアルデヒド CH3CHO に化学変化し、さらに酸化されると酢酸 CH3COOH になる。空気中で完全燃焼すると、二酸化炭素 CO2 と水 H2O を生じる。殺菌・消毒に用いられるほか、溶剤や燃料として用いられる。
目次
1 性質
1.1 合成
1.2 反応
1.3 共沸と精製
1.4 引火性
2 利用
2.1 飲料用
2.2 医薬として
2.3 食品添加物
2.4 自動車燃料
3 原料
4 薬局方
5 人体への影響
6 おもな誘導体
7 法的規制
7.1 危険物
7.2 飲用アルコール(酒類)
7.3 工業用アルコール
8 歴史
9 注釈
10 出典
11 参考文献
12 関連項目
13 外部リンク
性質
一般的な第一級アルコールとしての性質を持つ。また、炭化水素鎖が2つと充分に短く、親水性のヒドロキシ基の影響が強く出るために、プロトン性の極性溶媒である水と自由な割合で混和することが可能。そして2つとは言え、疎水性の炭化水素鎖を持っていることから、様々な有機溶媒とも比較的自由な割合で混和することが可能な場合がある。なお、エタノールそれ自体もれっきとした有機溶媒の1種に数えられ、様々な物質を溶解させる能力を持つ。この他、エタノール溶液は金属組織を顕微鏡観察し易くするための腐蝕液として用いられる。
合成
現在市場に出回っているエタノールは、大部分がアルコール発酵によって製造されている。
- C6H12O6⟶2C2H5OH+2CO2{displaystyle {ce {C6H12O6 -> 2C2H5OH + 2CO2}}}
一部は、化石燃料由来のエチレンの水和反応等の有機合成手法によっても製造される。
- C2H4+H2O⟶C2H5OH{displaystyle {ce {C2H4 + H2O -> C2H5OH}}}
反応
エタノールに濃硫酸を混ぜて、130〜140℃に加熱すると分子間脱水が起こり、ジエチルエーテルが生成する。
- 2C2H5OH⟶C2H5OC2H5+H2O{displaystyle {ce {2C2H5OH -> C2H5OC2H5 + H2O}}}
また、同じく濃硫酸を混ぜた状態で160〜170℃まで温度を上げると、今度は分子内脱水が起こり、エチレンが生成する。
- C2H5OH⟶C2H4+H2O{displaystyle {ce {C2H5OH -> C2H4 + H2O}}}
エタノールにある適当な酸化剤 [O] を作用させる、または脱水素反応などを施すとアセトアルデヒドに変わり、さらに強い酸化反応条件下では酢酸まで酸化される。人体内ではアルコール脱水素酵素によりアセトアルデヒドに分解された後さらにアルデヒド脱水素酵素に分解されて酢酸として体内に吸収される。ただしモンゴロイドにはアセトアルデヒドを高い効率で酸化して酢酸にするALDH2の活性の低いヒトや、活性を持たないヒトが、遺伝子多型の影響のため一定の比率で見られる。ALDH2の活性の低いヒトがエタノールを摂取すると、アセトアルデヒドの毒性による害が出やすい[注釈 2]。以上の酸化の過程を簡略した化学反応式で表すと以下のようになる。
- CH3CH2OH+[O]⟶CH3CHO+H2O{displaystyle {ce {CH3CH2OH + [O] -> CH3CHO + H2O}}}
- CH3CHO+[O]⟶CH3COOH{displaystyle {ce {CH3CHO + [O] -> CH3COOH}}}
エタノールに金属ナトリウムあるいは水素化ナトリウムを反応させると、水素ガスを発生しながらナトリウムエトキシドを生成する。
- 2C2H5OH+2Na⟶2C2H5ONa+H2↑{displaystyle {ce {2C2H5OH + 2Na -> 2C2H5ONa + H2 ^}}}
エタノールは第一級アルコールとして唯一 CH3CH(OH)- を構造中に持つため、ヨードホルム反応に対して陽性である。
- CH3CH2OH+6NaOH+4I2⟶CHI3+HCOONa+5NaI+5H2O{displaystyle {ce {CH3CH2OH + 6NaOH + 4I2 -> CHI3 + HCOONa + 5NaI + 5H2O}}}
燃焼時の反応で二酸化炭素と水が生成する。
- CH3CH2OH+3O2⟶2CO2+3H2O{displaystyle {ce {CH3CH2OH + 3O2 -> 2CO2 + 3H2O}}}
共沸と精製
水とエタノールの混合液を蒸留によって、2つの成分に完全に分離することはできない。これは水とエタノールが共沸をするためであり、この時の共沸混合物はエタノールが96%(質量パーセント濃度)、水が4%であるため、通常の蒸留によって得られるエタノールの最高濃度はおよそ96%である。ここにペンタン[注釈 3]などの成分が存在すると、始留に水分が集まるようになる。薬局方にある「無水エタノール」を作る時は、これら3成分の共沸によってさらに水分が除かれたのち、分別蒸留でさらに精製される。
引火性
エタノールは引火点が低く、非常に燃えやすい。
| wt % | 引火点 |
|---|---|
| 10% | 49 °C (120 °F) |
| 20% | 36 °C (97 °F) |
| 30% | 29 °C (84 °F) |
| 40% | 26 °C (79 °F) |
| 50% | 24 °C (75 °F) |
| 60% | 22 °C (72 °F) |
| 70% | 21 °C (70 °F) |
| 80% | 20 °C (68 °F) |
| 90% | 17 °C (63 °F) |
| 96% | 17 °C (63 °F) |
利用
溶剤(有機溶媒)、有機合成原料、消毒剤などとして広く使われている。用途別の使用量としては、飲用8%・工業用15%・燃料用77%である(2006年)[7]。工業用アルコールのうち、天然の原料から作った発酵アルコールは、食品の防腐用、みりんなどの調味料の原料などに使用され、化学合成された合成アルコールは接着剤、インク、塗料、農薬などに使用される[8]。
飲用(酒類)及び医薬品以外のエタノール(いわゆる工業用アルコール)はほとんどが変性アルコールと呼ばれるもので、エタノールにかなりの量あるいは少量のメタノールやイソプロパノールなどのアルコール類が混入されている[注釈 4]。したがって、酒として販売されているもの以外のアルコールを、「エタノール」と表示されているからといって、薄めて飲むなどといった行為は極めて危険である。
外用剤や化粧品等に用いられている変性アルコールは変性剤としてメタノールを使用しておらず有害性はやや低い。酒税を回避するため、メタノールよりは誤飲時の毒性が低いイソプロパノールを数%添加するか[注釈 5]、苦味や匂いを付加して飲用に適さないアルコールとしている。なお、平成12年からアルコール事業法が施行され、許可を取得すれば酒税相当分の価格を上乗せしていない無変性アルコールを取り扱えるようになった(後述)。
飲料用
エタノールの利用で最も古いものは、エタノールの含まれた飲料、すなわち酒を飲むことであり、有史以前からの歴史が存在する。以後長い間、飲料はエタノールの最大の用途となってきたが、2006年には飲料用のエタノール使用は総生産量の8%にまで低下しており、燃料や工業用に比べ小さなものとなっている[10]。
医薬として
メタノールやエチレングリコールを誤飲した場合の解毒剤として用いられる[11]。ただし解毒とは言っても、エタノールが直接メタノールなどの毒性を減弱させるのではなく、体内でメタノールなどから非常に有害な物質が一気に生成して、生体に大きな打撃を与えるのを防いでいるに過ぎない。以下、メタノールを例にとって説明する。
メタノールの代謝産物(酸化産物)であるホルムアルデヒドや蟻酸は、共にヒトにとっては非常に有害で、血中において高濃度になると失明などの原因となる。この時体内にエタノールを共存させると、ヒトの体内では代謝酵素との親和性の関係でメタノールよりもエタノールの方が酸化されやすいため、エタノールからアセトアルデヒド(有毒)や酢酸(事実上無害)ができやすい状態になり、他方でメタノールの酸化反応は速度が落ちる。これによってホルムアルデヒドや蟻酸の体内での濃度を上がりにくい状態に保ちながら、ホルムアルデヒドや蟻酸や代謝されなかったメタノール自体が体外へと排泄されたり、少しずつ生成するホルムアルデヒドや蟻酸が処理されるのを待っているに過ぎない。したがって、メタノールの摂取量にもよるものの、メタノールとその代謝産物の排泄が終わるまでエタノールを一定量ずつ摂取し続ける必要が出てくる。逆に、エタノールを一気に単回摂取しても効果は限られるし、エタノールの量が過ぎれば今度はエタノールとその代謝産物による害が出かねないことは留意する必要がある。ただそれでも、家庭においてメタノールを誤飲した場合は、エタノール(酒として市販されている品で構わない)を飲みながら病院を受診するという手は、メタノールとその代謝産物による害を最小にする応急処置として有用と言える。
食品添加物
殺菌料として食品添加物に用いられる。
自動車燃料
| 燃料 | MJ/L | MJ/kg | オクタン価 |
|---|---|---|---|
| 薪 | ~19.5 | ||
| メタノール | 17.9 | 19.9 | 108.7[13] |
| エタノール | 21.2[14] | 26.8[14] | 108.6[13] |
E85 (85%エタノール、15%ガソリン) | 25.2 | 33.2 | 105 |
| 液化天然ガス | 25.3 | ~55 | |
LPG (60% プロパン + 40% ブタン) | 26.8 | 50 | |
| 航空機用ガソリン (ジェット燃料ではなく、高オクタン価ガソリン) | 33.5 | 46.8 | 100/130 (リーン/リッチ) |
ガソール (90%ガソリン+ 10%エタノール) | 33.7 | 47.1 | 93/94 |
| レギュラーガソリン | 34.8 | 44.4[15] | min. 91 |
| プレミアム・ガソリン | max. 104 | ||
| 軽油 | 38.6 | 45.4 | 25 |
| 木炭 | 50 | 23 |

ブラジルの燃料スタンド。自動車燃料用のエタノールも販売されている。
近年、石油の代替燃料としてのエタノールの自動車用燃料用途に注目が集まっている。こうしたエタノール燃料はサトウキビやトウモロコシなどの植物、いわゆるバイオマスから生成されるものであり、バイオマスエタノールとよばれる。
自動車の登場期にすでに燃料として使われており、フォード・モデルTもエタノールの燃料使用が当初は考慮されていた[16]。米国では、1920年代にゼネラルモーターズが石油会社と共に(会社の利益となる)有鉛ガソリンを推進するようになったため、以降ほとんど使われなくなった。
フランスでは、1920年代から1950年代頃には砂糖大根で作ったエタノールをガソリンに混ぜて使っていた。石油が安価に手に入るようになりほとんどの国ではエタノールを使わなくなった。しかし、ブラジルでは、1973年の石油ショックによる原油価格の高騰に対処するため、政府が1975年からプロアルコール(Proalcool)政策を実施し、自国で豊富にとれるサトウキビから生産できるエタノールをガソリン代替にすることを進めてきた[17]。1977年にフォルクスワーゲン・ブラジリアを皮切りに導入され、既にブラジルでは年間に販売される新車の半数以上がエタノール燃料に対応した車となっている。2003年よりブラジルでのガソリンに対するエタノール混合率は25%となっている。
アメリカ合衆国でも、1970年代から中西部のとうもろこし生産地帯においてエタノール混合率10%のガソリン「ガソホール」が販売されてきた。1990年代になると、クリーンエア・アクト(大気浄化法)にもとづき、エタノール混合に優遇措置がなされた。これらは米国では農業生産者が政治に対して力をもっているからなしえたことでもあった。2000年代になり、米国内では、州によって状況が異なるが、通常E10とよばれる10%混合ガソリンが広く販売されるようになっている[18]。しかし、すべての米国人がその実態を知っているとはいえない程度である。エタノールとガソリンの混合燃料(フレックス燃料)に対応した車(フレックス車)の販売も増加している。通常の米国車は基本的にE10対応となっており、普通にガソリンをいれていると思いながらE10フレックス燃料をいれているようなケースも実際には多く、使用者の意識がなくともフレックスを使用している場合がある。米国ではフレックスに対応している車はE10対応、E25対応とよばれるが、E10対応はすでに標準であり、フォードではE85というような車も販売をはじめている[19]。
日本においては、実験を進めていた経済産業省が、コストの観点から日本国内での生産よりも輸入によることによる普及促進を狙い、2006年2月にブラジルの国営石油会社ペトロブラスと日本の日本アルコール販売の50%出資で、「日伯エタノール」を設立した。2007年2月時点で経済産業省の政策に対し石油会社の協力が得られておらず、ガソリンとの混合およびその販売にはまだ明確な道筋が立っていない。日本の法制度上では、過去にメタノールが主成分のガイアックスを高濃度アルコール燃料と名指しした上で事実上の販売禁止令を発布した経緯があり、その際に自動車部品への安全性を確保する基準とされた「アルコール添加量3%以下(E3相当)」という文面が現在でも法的根拠として残り続けていることや、「高濃度アルコール燃料」に対する過度のバッシングによる悪印象が未だ尾を引いている事から、E3以上の濃度のアルコール燃料の普及の目処は全く立っていないことが現状である。
モータースポーツのインディカー・シリーズでは2007年より98%エタノール燃料(飲用防止と発火を目視できるように2%のガソリンを混ぜてある)を使用している。
原料
工業的に生産されるエタノールの原料は、主に糖質とデンプン質のものに大別される。糖質原料としてはサトウキビが主に使用されるが、テンサイが使用されることもある。これらからとれる廃糖蜜(モラセス)も重要な原料のひとつである。デンプン質の原料として最も使用されるものはトウモロコシであり、ほかにソルガム(スイートソルガム)やコムギなどの麦類などの穀物や、ジャガイモやサツマイモといったイモ類が使用される[20]。
このほかにも、炭水化物か糖が含まれていれば原理的にはエタノールを生成できるため、さまざまな原料が使用されている。酪農においてチーズを製造したのちの乳清(ホエー)にも糖分が含まれているためニュージーランドではエタノール原料となっており[21]、また木材パルプ製造後の廃液にも糖分が含まれているため、カナダやロシアなどで原料として使用されている[22]。このほか、原理的には木材に含まれるセルロースを分解してエタノールを製造することも可能であり、技術自体は確立しているものの、コスト面で引き合わず生産はごく小規模にとどまっている[23]。
21世紀に入ってから、特にアメリカを中心としてエタノール燃料の需要が急拡大し、エタノール用のトウモロコシ需要は1998年の1300万tから2007年には8100万tにまで急拡大する[24]など、トウモロコシやサトウキビの生産の多くがエタノール生産へと投入されるようになったが、こうした作物ではこれまでの食用・飼料用の需要と食い合う形となったために価格が急騰し、特にトウモロコシを食用として使用していた国家を中心に食糧危機が発生して、2007年-2008年の世界食料価格危機を引き起こした原因のひとつとなったという説もある[25]。
薬局方

消毒用エタノール(阪神局方製)
日本では日本薬局方により純度が規定されている。
- 無水エタノール(別名:無水アルコール)
- 15℃でエタノールを99.5v/v%以上含む。消毒効果は消毒用エタノールに比べて小さいが、肝癌治療に応用されている。
- エタノール(別名:アルコール)
- 15℃でエタノールを95.1〜96.9v/v%含む。
消毒用エタノール(別名:消毒用アルコール)- 15℃でエタノールを76.9〜81.4v/v%含む。一般的な医療用消毒剤。
医薬用の(日本薬局方の)エタノールは酒税相当額が課税されている。節税のため、イソプロパノールを添加したものや変性アルコールを用いたものもあり、逆性石鹸で消毒の効力を高めた物もある。
人体への影響
ヒトがエタノールを摂取すると、中枢神経系を抑制する効果により酔いという急性の症状が現れる。また、その量が多くなると、中枢の抑制のため呼吸が停止するなどして死亡することもある。ヒトにおける致死量には個体差が見られるものの、1400 (mg/kg)程度がヒトのLDLo(最小致死量)とされている[2]。これがいわゆる急性アルコール中毒による死である。
この他、飲酒習慣のあるヒトはエタノールを繰り返し摂取することになるわけだが、エタノールを長期にわたって摂取し続けると脳萎縮が発生する。その他にエタノールには発がん性も指摘されており、IARC発がん性リスク一覧では「グループ1:発がん性がある」と分類される[26]。そして、脂肪肝やアルコール性肝炎、さらには肝硬変の原因にもなり得る。なお、妊婦が飲酒した場合は胎児に影響を及ぼし、例えば胎児性アルコール症候群(FAS)の原因となる[2]。
殺菌・消毒といった外用に用いた場合では人体への影響はほぼ無視できるものの、エタノールの濃度が非常に高いため飲用した場合は急性アルコール中毒を引き起す危険性が高い。他に消毒用エタノールの中には酒税の課税を回避するためにメタノールなどが意図的に混入されていることもあるものの、メタノールなどを含むものは人体に摂取すると重篤な症状を引き起こす危険がある。また傷口や粘膜に使用した場合は刺激が強く、痛みを感ずるために、基本的には正常な皮膚にしか使用しない。しかし、エタノールには有機溶剤としての作用があり、皮膚へ塗布した際には皮脂や水分を奪う。皮膚への過度な使用は控える必要がある。特にイソプロパノールのようにエタノール以上に皮脂を溶出しやすい物質が混入されたものはなおさらである。
おもな誘導体
- エチルメチルエーテル
- ジエチルエーテル
- エチルフェニルエーテル
- 酢酸
- 酢酸エチル
- ブロモエタン
- メタノール
法的規制
危険物

エタノールの燃焼の様子。
日本では消防法により危険物第4類(アルコール類 危険等級II)に指定されている[2]。航空法においては引火性液体に指定される[2]。
炎が青白色で、日中の太陽光のもとでは見えにくい。2013年8月4日、滋賀で消火訓練準備中に消防団員が火が消えたことを確認しエタノールを注ぎ足したところ爆発、女児が火だるまになる事故が起きた[27]。警察では火が消えたことの確認が不充分だったと見ている[28]。
飲用アルコール(酒類)
容積比率で1 %以上のエタノールを含む飲料は、酒税法により酒類と呼ばれ[29]、この製造や販売には所轄税務署長の免許(製造免許や販売業免許)が必要である[30]。酒税法では、酒類を製造所から移出するとき、または保税地域から引き取る際に酒税を納めることを義務付けている[31]。同法ではさらに、さまざまな種類の酒類を規定し[32]、種類に応じた税率を定める[33]。
工業用アルコール
工業用に作られたエタノールが酒税法で定める酒類に転用されるのを防ぐために、昭和12年(1937年)に制定された旧アルコール専売法や平成12年(2000年)に制定されたアルコール事業法では、容積比で90%のエタノールを含むアルコールの製造・使用・流通を制限ないし管理している。
旧アルコール専売法の下では公示価格が設定され[34]、酒類に転用するには高すぎる価格(酒税相当分が加算された価格)で販売された。工業用に使用するアルコールにはこの公示価格は適用されなかったが、その場合は添加物を加えて飲用不可の状態とすること(変性アルコール)が義務づけられていた[35]。
アルコール事業法が施行され、専売制が廃止された後は、変性アルコールでないアルコール(一般アルコール[36]、無変性アルコール[9]、事業法アルコール[37]などと呼ばれる。)も自由に取引できるようになった。ただし、製造・輸入・使用・販売には経済産業大臣の許可が必要である[38]。なお、製造業者や輸入業者は省令で定められた加算額を含む価格で工業用アルコールを販売することができ、これを特定アルコール[39]という。特定アルコールは許可を受けずに誰でも購入して自由に使用することができる。
工業用アルコールには、その原料・製造方法の違いにより発酵アルコールと合成アルコールの2種類がある。発酵アルコールはサトウキビから作った糖蜜などを原料として、それを発酵させて作る。合成アルコールはエチレンから化学的に合成されたものである。合成アルコールは、旧食品衛生法でいうところの化学的合成品[40]にあたり、添加物としても食品に使用できないと定められている[41]。
歴史
エタノールを含有する飲料は、有史以前から世界各地で醸造されてきた。これらの醸造酒から誰が最初にエタノールを単離したのかは、よく分かっていない[42][43]。一説には、サレルノのサレルヌス(Magister Salernus, 1167年没)がエタノール蒸留の発案者とされる[42]。フィレンツェのタッデオ・アルデロッティ(1295年没)が著した『生命の水について』De virtutibus aquae vitae には、エタノールの蒸留法とその薬用価値が記されている[43][44]。「生命の水」(aqua vitae) は、中世ヨーロッパにおけるエタノールの呼称である[42]。火を着ければ燃えることから、「燃える水」(aqua ardens) とも呼ばれた[45]。
タッデオの水冷式蒸留器により得られるエタノールの純度は、90パーセントと推定されている[43]。無水エタノール、すなわち水をほとんど含まない純粋なエタノールは、1796年にペテルブルクのヨーハン・トビアス・ローヴィッツが初めてつくった[46]。
注釈
融点・沸点 摂氏と華氏とケルビンが小数点以下で一致していません。摂氏温度が正しいのは確認済 融点-114.14 ℃:HSDB(2013)、沸点は引用先で異なる 沸点78.29℃ :HSDB(2013)、 沸点78.5℃ :Merck (14th, 2006)
^ 重量パーセント (wt%)。15℃での体積パーセント (vol%) は95〜96vol%[4]。
^ 急性アルコール中毒はエタノールを短時間に過剰摂取すれば、ALDH2の活性の有無を問わず、誰でも発症する。ALDH2の活性によって大きく変わるのは、少量のエタノール摂取によって吐き気などのアセトアルデヒドの悪影響が出てくるかどうかである。ALDH2の活性が高いヒトは、少々のエタノールを摂取したところで、エタノールの代謝によって体内で発生するアセトアルデヒドもすぐに処理できてしまえるので悪影響が出にくい。そうでないヒトは、アセトアルデヒドによる悪影響が出やすいということ。
^ かつては、ベンゼンが用いられていたが、発がん性、毒性のため、近年ではペンタンが用いられている[5]。
^ 平成12年12月26日付け厚生省の通達[9]末尾のアルコール専売法施行規則別表「工業用アルコール変性標準」の抜粋より。
^ イソプロパノールはメタノールよりも炭素鎖が長いために、油を溶かす能力は高い。したがって、外用した場合は皮膚から脂分を取り去り、手荒れなどの原因になりやすいのはイソプロパノールとされる。
出典
^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ abcdef MSDS- アルコール(99) (Report). 日本アルコール産業. (2013-01-01). http://www.j-alco.com/qc/pdf/MSDS99GHS_130101.pdf.
^ 『化学辞典』「エタノール」。
^ エタノール水溶液の容量%と比重及び重量%等との関係
^ 製造方法概要 - 日本合成アルコール株式会社
^ “Flash points of ethanol-based water solutions”. Engineeringtoolbox.com. 2011年6月23日閲覧。
^ 「図解 バイオエタノール最前線 改訂版」p50 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 総務省のウェブサイトにある資料 - アルコール専売事業(2001年に廃止)の仕組みをあらわしたもの(2010年12月01日閲覧)。
- ^ ab“変性アルコールの例”. 2011年10月20日時点のオリジナルよりアーカイブ。2010年11月29日閲覧。
^ 「図解 バイオエタノール最前線 改訂版」p50 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ “Methanol poisoning”. MedlinePlus. National Institute of Health (2013年1月30日). 2015年4月6日閲覧。
^ “Appendix B – Transportation Energy Data Book”. Center for Transportation Analysis of the Oak Ridge National Laboratory. 2019年3月5日閲覧。
- ^ abEyidogan, Muharrem; Ozsezen, Ahmet Necati; Canakci, Mustafa; Turkcan, Ali (2010). “Impact of alcohol–gasoline fuel blends on the performance and combustion characteristics of an SI engine”. Fuel 89 (10): 2713–2720. doi:10.1016/j.fuel.2010.01.032.
- ^ abThomas, George: “Overview of Storage Development DOE Hydrogen Program”. 2019年3月5日閲覧。 (99.6 KB). Livermore, CA. Sandia National Laboratories. 2000.
^ Thomas, George (2000年). “Overview of Storage Development DOE Hydrogen Program”. Sandia National Laboratories. http://www1.eere.energy.gov/hydrogenandfuelcells/pdfs/storage.pdf 2009年8月1日閲覧。
^ 「図解 バイオエタノール最前線 改訂版」p21 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 「図解 バイオエタノール最前線 改訂版」p91 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 「図解 バイオエタノール最前線 改訂版」p55 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ Ford Motor Company - Ethanol(2003年3月14日時点のアーカイブ)
^ 「図解 バイオエタノール最前線 改訂版」p15-16 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 「図解 バイオエタノール最前線 改訂版」p123 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 「図解 バイオエタノール最前線 改訂版」p125 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 「図解 バイオエタノール最前線 改訂版」p125 大聖泰弘・三井物産株式会社編 工業調査会 2008年5月25日改訂版1刷発行
^ 「絵で見る 食糧ビジネスのしくみ」p146-147 榎本裕洋、安部直樹著 柴田明夫監修 日本能率協会マネジメントセンター 2008年8月30日初版第1刷
^ http://www.mofa.go.jp/mofaj/press/pr/wakaru/topics/vol2/ 日本国外務省「わかる!国際情勢 食料価格高騰~世界の食料安全保障~」2008年7月17日 2019年3月4日閲覧
^ Agents Classified by the IARC Monographs, Volumes 1–111. monographs.iarc.fr
^ “消火訓練で10人やけど 滋賀、アルコールが飛散”. 日経新聞. (2013年8月4日). http://www.nikkei.com/article/DGXNASDG0400X_U3A800C1CC1000/
^ “エタノールの「見えない炎」、消火訓練準備で10人やけど”. TBS. (2013年8月5日). http://news.tbs.co.jp/20130805/newseye/tbs_newseye5401821.html [リンク切れ]
^ 酒税法第二条
^ 同第七条、第九条
^ 同第六条
^ 同第三条
^ 同第二十三条
^ アルコール専売法十九条
^ 同第二十六条
^ 三協化学株式会社のウェブサイト(2010年11月29日閲覧)
^ 日本アルコール販売のウェブサイト(2010年11月29日閲覧)
^ アルコール事業法第三条、第十六条、第二十一条、第二十六条。
^ 同第二条
^ 旧食品衛生法第二条第三項
^ 食品衛生法第十条。食品衛生法施行規則第十二条別表第一(使用を認められている添加物の一覧表)も参照。
- ^ abc『化学史事典』「アルコール」。
- ^ abcホームヤード (1996), pp. 35-36.
^ アイド (1972), p. 18.
^ アイド (1972), p. 17.
^ アイド (1972), p. 169.
参考文献
- 『化学辞典』 吉村壽次 編、森北出版、2009年、第2版。.mw-parser-output cite.citation{font-style:inherit}.mw-parser-output .citation q{quotes:"""""""'""'"}.mw-parser-output .citation .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-ws-icon a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-maint{display:none;color:#33aa33;margin-left:0.3em}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
ISBN 978-4-627-24012-4。 - 『化学史事典』 化学史学会 編、化学同人、2017年。
ISBN 978-4-7598-1839-0。 - E.J.ホームヤード 『錬金術の歴史―近代化学の起源』 大沼正則監訳、朝倉書店〈科学史ライブラリー〉、1996年。
ISBN 978-4254105711。 - アーロン・J. アイド 『現代化学史』1 (基礎理論の時代)、鎌谷親善、藤井清久、藤田千枝 訳、みすず書房、1972年。
ISBN 4622024217。
NCID BN00690017。
関連項目
アルコール - メタノール、1-プロパノール、2-プロパノール
- エーテル
- カルボン酸
- アルコール飲料
- アルコール燃料
- バイオマスエタノール
外部リンク
エタノール(エチルアルコール) 理科ねっとわーく(一般公開版) - 文部科学省 国立教育政策研究所
| ||||||||||||||||||
| ||||||||||




![{displaystyle {ce {CH3CH2OH + [O] -> CH3CHO + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ffaf9e5b0eee5fe0303a3e93592f7f5eae221356)
![{displaystyle {ce {CH3CHO + [O] -> CH3COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c01475f89526dd60663e4561554599e1390f7563)


