Alcaloide

Fórmula de la cafeína, un alcaloide estimulante.
Se llama alcaloides (de álcali, "carbonatos de alcalinos", y -oide, "parecido a", "en forma de") a aquellos metabolitos secundarios de las plantas sintetizados, generalmente, a partir de aminoácidos, que tienen en común su hidrosolubilidad a pH ácido y su solubilidad en solventes orgánicos a pH alcalino. Los alcaloides verdaderos derivan de un aminoácido; por lo tanto son nitrogenados. Todos los que presentan el grupo funcional amina o imina son básicos. La mayoría de los alcaloides poseen acción fisiológica intensa en los animales incluso a bajas dosis con efectos psicoactivos, por lo que se emplean mucho para tratar problemas de la mente y calmar el dolor. Ejemplos conocidos son la cocaína, la morfina, la atropina, la colchicina, la quinina, la cafeína, la estricnina y la nicotina.
Sus estructuras químicas son variadas.[1] Se considera que un alcaloide es, por definición, un compuesto químico que posee un nitrógeno heterocíclico procedente del metabolismo de aminoácidos; de proceder de otra vía, se define como pseudoalcaloide.[2]
Índice
1 Historia y evolución del término
2 Actividad biológica
3 Fitoquímica
4 Clasificación por estructura química
4.1 Compuestos no heterocíclicos
4.2 Estructuras heterocíclicas
5 Clasificación por biosíntesis
5.1 Protoalcaloides
5.1.1 Aminas
5.1.2 Amidas
5.1.3 Guanidinas
5.2 Alcaloides verdaderos
5.2.1 Alcaloides derivados de la serina, la cisteína y la glicina
5.2.1.1 Serina
5.2.1.2 Cisteína
5.2.1.3 Glicina
5.2.2 Alcaloides derivados del aspartato
5.2.2.1 Aspartato y asparagina
5.2.2.2 Treonina
5.2.2.3 Metionina
5.2.2.4 Nicotinato
5.2.3 Alcaloides derivados de aminoácidos de la familia del glutamato
5.2.3.1 Glutamato y glutamina
5.2.3.2 Prolina
5.2.3.3 Ornitina y arginina
5.2.4 Derivados del porfibilinógeno
5.2.5 Alcaloides derivados de la lisina
5.2.6 Alcaloides derivados de la fenilalanina y tirosina
5.2.6.1 Alcaloides de la Securinega
5.2.6.2 Heterociclos formados por ensamblaje
5.2.6.3 Alcaloides isoquinolínicos
5.2.6.4 Alcaloides fenantroindolizidínicos y fenantroquinolizidínicos
5.2.6.5 Alcaloides norbeladínicos y mesembrenoides
5.2.6.6 Alcaloides dibenzoquinolizínicos y dibenzoindolizínicos
5.2.6.7 Citocalasinas y pseurotinas
5.2.6.8 Alcaloides de la ciclo-DOPA
5.2.6.9 Alcaloides de la seco-DOPA
5.2.7 Alcaloides derivados del antranilato
5.2.7.1 Protoalcaloides del antranilato
5.2.7.2 Alcaloides fenazínicos
5.2.7.3 Policétidos mixtos con ácido antranílico
5.2.7.4 Alcaloides quinazolínicos
5.2.7.5 Alcaloides indólicos
5.2.7.6 Alcaloides β-carbolínicos
5.2.7.7 Alcaloides del ergot y otros indolterpénicos
5.2.7.8 Dímeros del triptófano
5.2.7.9 Alcaloides derivados de la quinurenina
5.2.7.10 Anhidropéptidos del triptófano
5.2.7.11 Alcaloides quetoglobosánicos
5.2.8 Alcaloides derivados de la histidina
5.2.9 Alcaloides derivados de los aminoácidos ramificados
5.3 Genalcaloides
5.4 Pseudoalcaloides
6 Quimiotaxonomía
6.1 Alcaloides de bacterias y arqueas
6.2 Alcaloides aislados de algas y protozoarios
6.3 Alcaloides aislados de hongos
6.4 Alcaloides aislados de plantas
6.5 Alcaloides aislados de animales
7 Véase también
8 Referencias
9 Enlaces externos
Historia y evolución del término
El nombre alcaloide fue acuñado por el químico alemán Carl Friedrich Wilhelm Meissner en 1819 para referirse a productos naturales de origen vegetal que mostraban propiedades básicas similares a los álcalis. Dada la información estructural limitada en aquellos tiempos, la definición de Meissner resultaba vaga. Königs reservaba el nombre “alcaloide” a compuestos básicos relacionados con la piridina, y Guereschi consideraba el término como sinónimo de “base vegetal”. Winterstein y Trier (1910) consideraban alcaloides en sentido amplio a todos los compuestos provenientes de cualquier ser vivo que contienen nitrógeno básico. Estos autores distinguían entre un alcaloide verdadero y una base relacionada con los alcaloides. Un compuesto, de acuerdo con esta definición, debía cumplir los siguientes requisitos:
- Presentar un nitrógeno básico
- El nitrógeno debe estar incluido en un sistema heterocíclico
- Tener una estructura compleja
- Presentar actividad farmacológica potente
- Tener una distribución restringida a las plantas
A medida que avanzaron los estudios en productos naturales, se han ido descubriendo compuestos que son considerados alcaloides, pero no cumplen con alguno de estos requisitos: muchos alcaloides no presentan sistemas heterocíclicos, su nitrógeno no es básico (como los grupos nitro), pueden presentar estructuras simples (como el caso de la efedrina, muchas amidas -como la capsaicina)- pueden ser inertes farmacológicamente y muchos alcaloides han sido aislados de animales.
Hegnauer (1960) clasificó los alcaloides en tres tipos: alcaloides verdaderos, pseudoalcaloides y protoalcaloides. El término secoalcaloide se infiere de la nomenclatura de productos naturales y se considera aquí como una cuarta categoría:
- a) Alcaloides verdaderos: Metabolitos secundarios que poseen un nitrógeno heterocíclico, y su esqueleto de carbono proviene, parcial o totalmente, de un aminoácido proteínico.
- b) Pseudoalcaloides: Metabolitos secundarios que poseen un nitrógeno, pero que no han sido biosintetizados a partir de aminoácidos sino que se forman por transferencia de nitrógeno en forma de amoniaco a un compuesto de origen terpénico, esteroide, policétido, monosacárido o a un ácido graso.
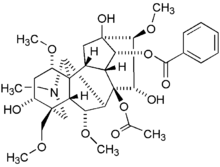
La aconitina, un pseudoalcaloide producido por especies de Aconitum y Delphinium.
- c) Protoalcaloides: Metabolitos secundarios que no forman un sistema heterocíclico y se forman a partir de un aminoácido proteínico. Muchos de estos compuestos contienen un grupo amino, amida, etc.[3]
- d) Secoalcaloides: Alcaloides que provienen de un alcaloide verdadero, pero en los que por escisión del anillo heterocíclico se forma un grupo nitrogenado de cadena abierta.
- e) Genalcaloides: -u óxidos aminados de alcaloide- son derivados por oxidación de los alcaloides que contienen el grupo R=(NO)-R, donde el nitrógeno tiene número de oxidación +5, en contraposición a los alcaloides normales, donde es trivalente (R=N-R). Su acción es la misma que la del alcaloide del cual provienen, pero es más pausada. Se nombran añadiendo el prefijo gen- al nombre del alcaloide. Algunos genoalcaloides se encuentran en la naturaleza, como la geneserina (derivado del alcaloide eserina (fisostigmina)) presente en el haba de Calabar.[4]
Existen productos naturales cuya consideración como alcaloides se encuentra en debate:
- Las bases nitrogenadas (Adenina, timina, guanina, uracilo y citosina debido a su papel primario como componentes de nucleótidos y ácidos nucleicos.
- Los aminoácidos no proteínicos debido a que su actividad biológica no es por unión a un sitio receptor celular, sino porque reemplazan a los aminoácidos proteínicos y en consecuencia forman proteínas defectuosas.
- Los esfingolípidos, debido a que son componentes de membranas celulares.
- Las vitaminas (sobre todo las del complejo B) por ser consideradas metabolitos primarios con actividad catalítica.
- Los glucósidos cianogénicos debido a que su actividad biológica no es por unión a un sitio receptor celular, sino porque al hidrolizarse producen ácido cianhídrico, el cual es el que tiene la actividad biológica.
- Los glucosinolatos debido a que su actividad biológica no es por unión a un sitio receptor celular, sino porque al hidrolizarse producen isotiocianatos, los cuales son los que presentan la actividad biológica.
- Los aminoazúcares, tales como la glucosamina, por ser considerados más bien como glúcidos.
- Los tetrapirroles, tales como la porfirina y la corrina siguen en debate, ya que algunos de ellos son metabolitos secundarios (Como la turacina) y otros se consideran como primarios debido a que los metales como el hierro (Hemo) magnesio (Clorofilas) o cobre(Citocrominas) y funcionan como transportadores de oxígeno o electrones.
- Los péptidos no ribosomales, los anhidropéptidos y los antibióticos betalactámicos, siguen en debate ya que se pueden referir como alcaloides o no. Se les considerará en este artículo sólo como prototipos estructurales.
El aislamiento de los primeros alcaloides en el siglo XIX coincidió más o menos con la introducción del proceso de percolación para la extracción de las drogas. El farmacéutico francés Charles Derosne probablemente aisló en 1803 el alcaloide denominado después narcotina, y el farmacéutico Friedrich Sertürner investigó sobre el opio y aisló la morfina. A ello siguió rápidamente el aislamiento de otros alcaloides como la estricnina, cafeína, entre otros.
La cocaína es el alcaloide más antiguo en cuanto al establecimiento de su estructura y de su síntesis, pero otros, como la colchicina, necesitaron más de un siglo para que se definieran sus estructuras.
En el área mesoamericana, desde tiempos muy antiguos se ha utilizado gran variedad de alcaloides en la medicina tradicional maya. Las substancias psicotrópicas tanto alcaloides como alcoholes, se han utilizado por más de dos mil años con fines medicinales y en rituales ceremoniales. Su uso lo regulan las mujeres mayores de 39 años (3 x 13 ciclos de evolución biológica según su propia aproximación científica), y normalmente se administran de una forma ceremonial en que la persona que los ingiere está rodeada de otros miembros especializados de la comunidad.
Actividad biológica
Sus actividades biológicas son importantes por su mimetismo hormonal y su intervención en las reacciones principales del metabolismo celular. A pesar de ser sustancias poco similares entre ellas desde el punto de vista estructural, poseen propiedades fisiológicas análogas. Muchos alcaloides son la causa de intoxicaciones en humanos y animales. La forma más común es la intoxicación por infusiones con hierbas con fines medicinales, siendo esta una causa importante de muerte sobre todo en niños. Su presencia en vegetales hace posible su incorporación accidental en alimentos, creando una vía fácil de intoxicación.
Generalmente actúan sobre el sistema nervioso central, si bien algunos afectan al sistema nervioso parasimpático y otras al sistema nervioso simpático, por ejemplo, la cocaína actúa impidiendo la recaptación de dopamina de la terminal sináptica, lo que produce un mayor efecto de los receptores dopaminérgicos.
La actividad biológica de los alcaloides es muy diversa; la más estudiada es la acción euforizante que presentan algunos como la cocaína, si bien también existen alcaloides con efectos depresores del sistema nervioso central como la morfina.
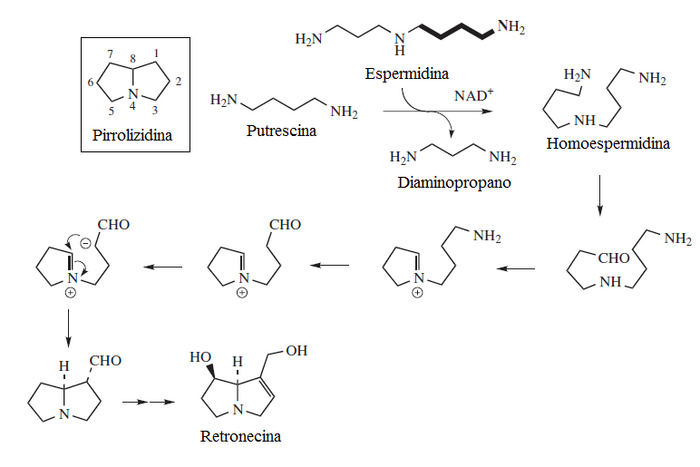
Los alcaloides pirrolidínicos están asociados con estructuras de pirrolizidinas; son metabolitos secundarios de una gran variedad de plantas, que incluye especies que se encuentran en todo el mundo. Estas plantas son la causa de numerosos casos de envenenamiento de ganado, y ha causado grandes pérdidas económicas. También son causa de muerte en humanos, especialmente en países poco desarrollados, como consecuencia de la contaminación de cereales y semillas por lo que son de gran importancia en el campo de los alimentos. Se cree que la ingestión de hierbas y vegetales que contienen estos alcaloides, son causa de dolencias. La estructura de estos alcaloides consiste en dos anillos de 5 átomos unidos que comparten un átomo de nitrógeno. En la naturaleza por lo general los anillos tienen como sustituyentes grupos hidroximetileno en la posición c-1 y grupos hidroxilos en c-7; esta estructura se conoce como necina. Ejemplos típicos de esta base son la heliotridina y la retronecina.
Fitoquímica
Los métodos de extracción son muy variados, pero últimamente está adquiriendo fuerza la purificación por medio de fluidos supercríticos, concretamente con dióxido de carbono.
Para obtener los alcaloides de los vegetales, se extraen de las partes de la planta que los contienen, con agua si están en forma de sales (solubles) o con ácido clorhídrico diluido si están en forma insoluble.
En cuanto a su detección, existen multitud de métodos: procedimientos cromatográficos, reacciones coloreadas (reacción de Mayer, de Dragendorff, de Bouchardat... si bien no son específicas de los alcaloides: puede obtenerse un resultado positivo en presencia, por ejemplo, de péptidos). Actualmente se utilizan métodos espectroscópicos tales como espectrometría de masas, resonancia magnética nuclear y espectroscopia infrarroja.
Clasificación por estructura química
Compuestos no heterocíclicos
Dado que los pseudoalcaloides no heterocíclicos, los protoalcaloides y secoalcaloides no tienen una estructura heterocíclica, se puede considerar que presentan una estructura hidrocarbonada muy diversa. En esta sección se clasificarán estos compuestos por su grupo funcional:
Grupo funcional | Estructura | Ejemplos |
|---|---|---|
Amina primaria | 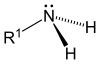 | aminas biógenas, ácido antranílico, ácido p-aminobenzoico, bleniona. |
Amina secundaria (R1 = H) o terciaria | 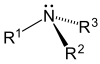 | Espermina, espermidina, sarcosina, peshawarina, narceína, joubertiamina, cordiformamida, lilacinona, lepiotaquinona, tetraciclinas, taspina. |
Sal de amonio cuaternaria |  | Betaínas, muscarinas. |
Amida primaria |  | Anandamida, nicotinamida, cerulenina, agrocibina. |
Amida secundaria y terciaria |  | Péptidos no ribosomales. Ceramidas. Bufotoxinas, capsaicina, herclavina, boletocrocinas, fagaramida, dasiclamida, turtschamida, subafilina, ocratoxinas, norbeladina, secopiriferina, secoodorina, secopirrolotenina, grandiamidas, paucina, subafilina, haplamidina, gloquidiatusamida, capsaicina, colchicina, jerusalemina, salimina, arnotianamida, curvulárido E, xilariamidas, fisariginas, escaurinas, boletocrocinas, melanocrocinas, lipstatina, antimicinas, zwittermicina, salicihalamidas, apicularenos. |
Guanidina |  | Galegina, creatina, hirudonina, esferofisinas, fontaineína |
Nitrilo | glucósidos cianogénicos | |
Diazo |  | Kinamicinas, agaritina, giromitrina, rubroflavina, craniformina, estefanosporina. |
Azoxi |  | Cicasina, azoxibacilina |
Nitro | 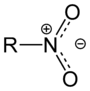 | Ácido β-nitropropiónico y sus ésteres, cloranfenicol, ácido aristolóquico, ácido 1-amino-2-nitrociclopentanocarboxílico, ácido 3-nitro-4-hidroxifenilacético, aureotina, miserotoxina, ascoclavina |
Hidroxilamina y oxima |  | Desferrioxaminas B, deferoxaminas, hadacidina, lobatamidas |
Estructuras heterocíclicas
A continuación se clasificarán los alcaloides y pseudoalcaloides de acuerdo con sus estructuras heterocíclicas.
| Nombre | Esqueleto | Ejemplos |
|---|---|---|
Aziridina | Ácido 2,3-aziridindicarboxílico, disidazirina. | |
Azetidina | Ácido azetidin-2-carboxílico, Ácido mugineico, 3-azetidinona, 3,3-azetidinodiol, SQ 26,180, nicotianamina, penaresidinas, penazetidinas, calidafninona, antibióticos betalactámicos. | |
Pirrol |  | Pirrolidinas: Cuscohigrina, higrina, higrolina, estaquidrina, ficina, vochisina, eleocarpina, dendrocrisaninas, agaricona, pirrociclinas, chabamida F, equisetina, fomasetina, salinosporamidas, pseurotinas, ácido kainico, ruspolinona, gerrardina, ácidos aminopirrolodincarboxílicos, anfiasterina C1 y C2, anisomicinas, antibiótico GKK 1032A2, barmumicina, brousonetinas, codonopsina, anisomicina, cucubalactama, detoxinina, hidroxipirrolidinas, divaricataéster A, donaxaridina; disibetaína, fulvanina A, involucratina, irniina, lanopilinas, ácido morusímico, ácido neoselaginélico, piperciclamida, radicamina A, rafanusanina, sarmentamida B, escalusamida A, sesilina, escuamolona, traquinona, uncinina, villatamina A, peripentadenina. Pirroles, pirrolonas y succinimidas: Ácidos pirrolocarboxílicos, ácido tenuazónico, porfirinas, porfibilinógeno, prodigiosinas, ryanodina, pirrolezantinas, ácido 3-pirrolacrílico, 2-cianopirrol, cistamidinas, farinomaleína, showdomicina, ácido pirrolo-2,3-dicarboxílico, ácido pirrolo-2,5-dicarboxílico, 5-(23-Ciano-23-hidroxi-6-tricosenil)-1H-pirrol-2-carboxaldehído, curvupálidos, batraciotoxina, himanimidas, paquidermina, policefalinas, ácido fisorubínico, variotina, pencólido, pirrolostatina, gliciapirroles, sarcotrinas, palinurinas, ircinamina, tambjaminas, kikumicinas, rumbrina, auxarconjugatinas, indanomicina, stawamicina, cafamicina, dioaxapirrolomicina. |
Imidazol |  | Ácido urocánico, histamina, murexina, diftamida, ergotionina, pilocarpina, dolicotelina, pilosina, nagelamidas, esceptrinas, clatrodina, oroidina, himenidina, keramadina, creatinina, policarpina, esteletazoles, crisofisarinas, lepidinas. |
Pirazol |  | β-pirazol-1-il alanina, pirazofurina |
Oxazol |  | Oxazolidinas: Goitrina, lipoxazolidinonas Oxazoles: Muscazona, hennoxazoles, rizoxina, forboxazol, anulolina, halfordinol, texalina, texamina, vibriobactina, curromicina A, martefraginas, almazolona, clavosinas, quivosazoles. |
Isoxazol | 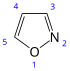 | Isoxazolidinas: Cicloserina Isoxazoles: Ácido iboténico, ácido tricolómico, muscimol. |
Tiazol |  | Epotilonas, tiamina, micrococcina, mixotiazoles, nostociclamidas, tiostreptona, raocilamidas, dendroamidas, tenuacilamidas, yersiniabactina, curacinas, venturamidas. |
1,2,4-oxadiazol |  | Ácido quisquálico |
Piridina |  | Piperidinas: Coniina, coniceína, pinidina, lobelanina, ácido pipecólico, glutanimina, indigoidina, sedamina, lobelina, anaferina, piperina, nufamina, nufaramina, carpaína, estenusina, ácido evonínico, ácido wilfórdico, ácido edulínico, evonina, rohitukina, crotacuminas, capitavina, cassina, himbacina, astrofilina, arenosclerina, haliclonaciclaminas, batzelásidos, lactidomicinas, estreptimidina, adenocarpina, amnodendrina, prosopinina, criptoforina . Piridinas: 4-Hidroxi-2-metilpiridina, Ácido nicotínico, ácido quinolínico, ácido picolínico, nicotina, miosmina, mimosina.hachijodinas, orellanina, anabasina, anabatina, trigonelina, ricinina, arecolina, homarina, guvacina, hermidina, ácido betalámico, betalaínas, gentianina, evonina, hipocrateína, wilfortrina, triptoninas, ácido fusárico, caripirina, nigrifactina, desmosina, xilopiridinas, euonimina, wilfordsina, cangorininas, maytenina, ebenifolina, wilfordconina, aspertinas, piericidinas, ácido evonínico, baikiaína. |
Pirimidina | 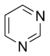 | Ectoína, capreomicidina, timina, citosina, uracilo, vicina, convicina, latirina, ácido barbitúrico |
Pirazina | 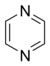 | Ácido pulcherrímico, ácido aspergílico, ligustrazina, riterazinas, anhidropéptidos, crotonina, dragmacidinas, sarcodoninas, sarcoviolinas, albornousina, picroroccelina, ácido rodotorúlico, equinulina, flavacol, micelianamida, barrenazinas. |
Piridazina |  | Piridazomicina, Piridazocidina |
Tiomorfolina |  | Condrina, ácido tiomorfolino-3-carboxílico, cicloaliina |
Azepina | 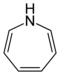 | Azepanos': Bengamidas, isobengamidas, muscaflavina, Ciliatamidas, ofiocordina, balanol, chalciporona, peritoxina A, ustalimida, amamistatina A, antibiótico A 500359A, balanol, calpinactama, capuramicina, carboximicobactinas, ciliatamida A, circinatina, drazepinona, formobactina, 4,8-difenil-5H-1,3-dioxolo[4,5-d]azepino-5,7(6H)-diona, montiporina E, nocardimicinas, peritoxina A, pestalactama A, solacina C. |
Azocina |  | Otonecina |
| Azacicloalcanos |  | Motuporaminas, macrociclolactamas, Keramafidina C |
| 7-azabiciclo[2.2.1]heptano | 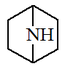 | Epibatidina |
Tropano | 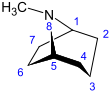 | Atropina, escopolamina, hiosciamina, cocaína, ecgonina, calisteginas |
| 9-Azabiciclo[3.3.1]nonano | 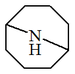 | Pseudopeletierina, eufococcinina |
Pirrolizidina | 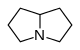 | Necinas: Retronecina, heliotridina, laburnina, indicina, lindelofina, sarracina, platifilina, tricodesmina, falenopsina, licopsamina, creatonotinas, calimorfina, supidina, rosmarinecina, danaiona, traquelantamidina, hastanecina, crotanecina, platinecina, turneforcidina, ipangulinas, minalobinas, pirrolamas, |
Indolizidina | 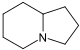 | Swainsonina, castanospermina, pumiliotoxinas, la lentiginosina, las poligonatinas, monomorina, eslaframina, serratinina. |
Indol |  | Ciclo-DOPA, oleraceínas, auxinas, glucobrassinina, escatol, triptamina, serotonina, aeruginascina, indol, indoxilo, isatina, camalexina, 5-(3’-metilbuten-2’-il)isatina, ascorbígenos, melosatinas, hipaforina, bufotenina, beocistina, plakohipaforinas, bromoindoles, indolmicina, Sinalexina, Convolutindol A, Petromindol, Brasilidinas, Dilemaonas, 5-MeO-DMT, 5,6-hidroxiindol, mesembrina, ésteres del triptofol, 1-(2-metilbut-3-en-2-il)-1H-indol-3-carboxilato de metilo, 1-(3,4-dihidroxi-2-metilbutan-2-il)-1H-indol-3-carboxilato de metilo, homolicorina, birnbauminas, cinereapirroles, fragilamida, martensinas, urdamicina D, violaceína, Convolutindol A. |
Isoindol | Citocalasinas, quetoglobosinas, cespitulactamas, hericerina, estereninas, clitocibinas. | |
Benzotiazol |  | Luciferina |
Benzoxazol | 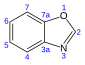 | Nakijinol, pseudopteroxazoles |
Indazol |  | Nigelidina, nigelicina, nigeglanina |
| Pirrolo[3,2-b]piridina |  | Laccarina, agrocibenina, cortamidinas |
| Pirrolo[1,2-a]pirazina | 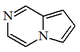 | Vercapamida A |
| Imidazo[1,2-a]pirazina | 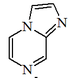 | Coelenteracina, vargulina |
Quinolina |  | 'Hidroquinolinas: Mirionina, tortuosamina 'Quinolinas: Ácido xanturénico, ácido quinurénico, 2-quinolinamina, quinolina, ácido quináldico, ácido cinconínico, lepidina, 4,8-Quinolinodiol, 2-quinolinametanotiol, 2-quinolinametanol, 4-quinolinametanol, 2,3,4,7,8-quinolinapentol, 2,3,4,7-quinolinatetrol, 2,3,4,8-quinolinatetrol, 2,4,6,8-quinolinatetrol, 2,4,7,8-quinolinatetrol, 3,4,5,8-quinolinatetrol, 2,3,4-quinolinatriol, 2,4,6-quinolinatriol, 2,4,8-quinolinatriol, 4,7,8-quinolinotriol, 2-quinolinol, 3-quinolinol, 4-quinolinol, 2(1H)-quinolinona, 4(1H)-quinolinona, viridicatina, cusparina, evocarpina, equinopsina, crispina E, dictamnina, fagarina, esterculinina. |
Isoquinolina | 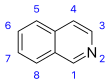 | Tetrahidroisoquinolinas: canadalina, filocriptina, filocriptonina, velucriptina, ceratonicina, Policarpina (Isoquinolina), anocherinas, macrostomina, arenina, compostelina, sarcocapninas, la gouregina, aristoyagonina, aristocularinas, cularina, secocularinas, noyaína, quetaminas, hidrastina, autumnalina, pisopowetina, pisopowiaridina, dauricina, vanuatina, malekulatina, ambrinina, neferina, rodiasina, tiliacorina, berbamina, oxiacantina, talicberanos, talidasanos, talmanos, tubocuraranos trilobina, repandulina, auroramina, pennsylpavina, baluchistanamina, epiberbivaldina, cancentrina, punjabina, gilgitina, talcamina, jhelumina, chenabina, karakoramina, ipecósido, korupensaminas, michelamina, habropetalinas, dioncofilina, liensinina, bicuculinina, talifarapina, pakistanamina. Isoquinolinas: Isoquinolina, salsolina, lofocerina, coridaldina, oxihidrastinina, ancistrocladinas, papaverina, laudanosina, sendaverina, papaveraldina, carcrisina B, fusarimida, cassiarinas, monascorubramina, fredericamicinas A y B, lagunamicina. |
Quinolizidina | 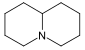 | Lupinina, nufaridina, nufarolutina, nufacristina, nufarpumilaminas. |
quinazolina | 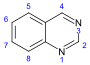 | Febrifuguina, glicorina, arborina, glicosminina, glicoscimina, glicofimolina, glomerina, homoglomerina, equinozolinona, tetrodotoxina, 2-acetilquinazolin-4(3H)-ona, 7-bromoquinazolino-2,4-diona, 7-hidroxiequinozolinona, dictioquinazoles. |
Quinoxalina | 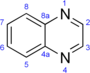 | Baimantuoluoamida B |
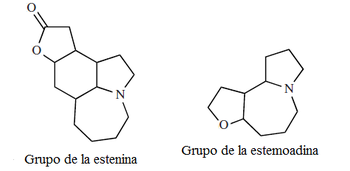
| 3H-Pirrolo[1,2-a]azepina | 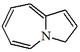 | Estemoadina |
| 3H-3-benzazepina | 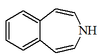 | Roeadina, papaverrubinas |
| 2,7-Naftiridina |  | Lofocladinas |
Purina | 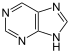 | Xantosina, adenina, guanina, cordicepina, eritadeninas, nebularina, citoquininas, cafeína, teofilina, teobromina. |
Pteridina | 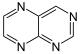 | Biopterinas, leucopterina, xantopterina |
| Pirimido[5,4-e][1,2,4]triazina | 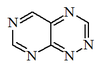 | Reumitsina, toxoflavina. |
| Pirazolo[4,3-e][1,2,4]triazina |  | Fluvioles |
Carbazol |  | 3-Metilcarbazol, 3-Formilcarbazol, Ácido 3-carbazolcarboxílico, 1-Hidroxi-3-metilcarbazol, clausinas, murrayafolinas, koenolina, murrayanina, ácido mukoénico, mukonina, 2-hidroxi-3-metilcarbazol, mukonal, mukonidina, 2-metoxi-3-metilcarbazol, glicosinina, heptafilina., currayanina, exozolina, carquinostatinas |
Acridina |  | Rutacridona, melicopidina, Xantevodina, eskimianina. |
Fenazina |  | Piocianina, aeruginosinas. |
Fenoxazina | 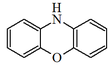 | Cinabarina, ácido cinabarínico, tramesanguina, polistictina, fenoxazona, α-aminofenoxazona, orceínas, picnoporina. |
| Benzo[g]isoquinolina | 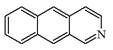 | Tolipocladina |
| Benzo[g]quinolina | 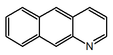 | Cleistofolina |
| 4H-1,4-benzoxazina | 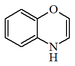 | DIMBOA |
Quinuclidina | 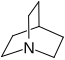 | Quinina quinidina cinconina, cinchonidina. |
| 1,2-Dihidroespiro[indol-3,3'-pirrolidina] |  | Coerulescina, Horsfilina |
β-Carbolina |  | Harmano, harmina, harmalina, eleagnina, cecilina, tripargimina, bruneínas, flazina, flazinamida. |
| Benzo[g]pteridina | 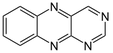 | Lumazina, Limicromo, isoaloxazinas, roseoflavina |
| 7H-dibenzo[d,f]azonina | 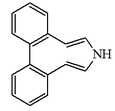 | Protostefanina |
| Benzo[h]isoquinolina |  | Chiloenina, santiagonamina |
| Fenantridina | 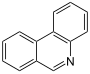 | Crinina |
| Benzo[c]cinolina | 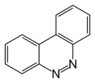 | Necatorina |
| Pirido[1,2-a]indol | 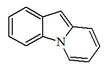 | Gliotoxina, dioxopirazinoindoles |
| Pirido[2,1,6-de]quinolizina | 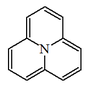 | Coccinelina, mirrina, precoccinelina, hipodamina, convergina, poranterina, porantelidina, porantericina, propileína |
| 11bH-pirido[2,1-a]isoquinolina | 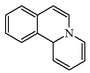 | Emetina |
| Pirrolo [2,1-a]isoquinolina | 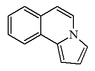 | Lamelarinas |
| Pirrolo[4,3,2-de]quinolina | 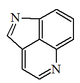 | Micearubinas, makaluvaminas, damirona C, hematopodinas. |
| 2H-1,8,8b-Triazaacenaftileno | 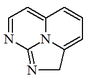 | Cilindrospermopsina y sus derivados. |
| 5H-5,6,8b-Triazaacenaftileno | 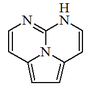 | Ptilomicalinas, batzeladinas, cambrescidinas. |
| 9aH-5,8-diazabenzo[cd]azuleno | 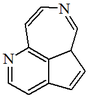 | Aaptosamina |
4H-benzo[de][1,6]-naftiridina |  | Aaptaminas, isoaaptaminas |
| Pirido[2,1-j]quinolina |  | Cilindricina B, fasicularina, policitorol A |
| 1H-pirrolo[2,1-j]quinolina |  | Cilindricinas A, K, D, E, J, I; Lepadiforminas A y B. |
| 1,8-dihidropirrolo[2,3-b]indol |  | Fisostigmina (eserina), eteramina, fisovenina, eptastigmina, flustraminas. |
| 5H,10H-Dipirrolo[1,2-a:1',2'-d]pirazina | Vercapamida C, pirocol, aranotina. | |
| 2-oxa-6-azatriciclo[4.2.1.03,7]nonano. | 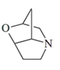 | Lolinas, temulina |
| Dibenzo[c,g]azecina | 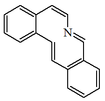 | Protopina, coricavamina, coricavidina. |
| Dibenzo[b,i]quinolizina |  | Cohirsina, shaheenina, cohirsinina, cohirsitinina. |
| Pirrolo 2,1,5-cdindolizina | 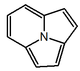 | Mirmicarinas |
| 1H,10H-pirrolo[1,2-c]purina | 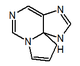 | Saxitoxinas |
| Indolo[2,1-a]isoquinolina |  | Criptowolidina, criptowolinol, criptowolina. |
| 9H-Indeno[2,1-b]piridina |  | Haouamina |
| Azepino[3,2,1-hi]indol |  | Estenina, tuberostemonina, estemoamida, estemonina, neostemonina, croomina, estemonidina. |
| 6,10-Metano-4,6-dihidropirido[1,2-a]azepina |  | Securiniaminas, sufruticodina, securinoles, filocrisina |
| 2,5-Metano-9H-pirido[1,2-b][1,2]oxazepina | 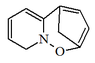 | Filantidina, secuamamida D |
| 4H-dibenzo[de,g]quinolina |  | Alcaloides aporfinoides: Glaucina, boldina, bulbocapnina, nanteína, hernandialina, nuciferina, liriodenina, pukateína, laurotetamina, lauroscolzina, escolina, magnoflorina, duguenaína y pancoridina, talifaberina, urabaína, dehatrifina |
| 7H-dibenzo[de,h]quinolina |  | Menisporfina |
| Indeno[1,2,3-ij]isoquinolina | 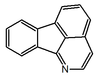 | Rufescina, imeluteína |
| 1,2-Epimino-3H-pirrolo[1,2-a]indol | 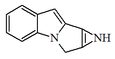 | Mitomicinas |
Eupolauridina |  | Eupolauridina y sus derivados |
| Pirrolo[3,2,1-de]fenantridina |  | Licorina |
| 7H-Nafto[1,2,3-ij][2,7]naftiridina | 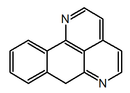 | Sampangina, eupomatidinas |
| Espiro[2,5-ciclohexadieno-1,7'(1'H)-ciclopenta[ij]isoquinolina] | 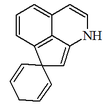 | Orientalinona, glaziovina, estefarina, mecambrina, pronuciferina. Dímero: Roehibridina |
| 1,2-dihidrospiro[2-H-indeno-2,1'-isoquinolina] | 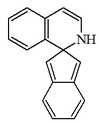 | Lahorina |
| Benzo[d]-[4,5-g]pirido[4,3,2-jk][2]benzazepina | 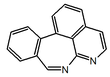 | Dragabina |
Esparteína | 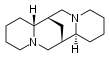 | Esparteína |
1H,4H,9H-Dipirido[2,1-b:3',2',1'-ij]quinazolina | 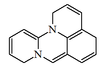 | Sibiridina, schoberina |
| Morfinano | 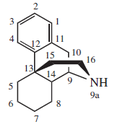 | Codeína, tebaína, salutarina, morfina, oripavina |
| Hasubanano | 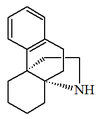 | Hasubanonina, cefaramina, cefasamina |
| (1S,9R)-7,11-diazatriciclo[7.3.1.02,7]tridecano | 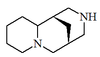 | Citisina, angustifolina |
| Dibenzo[f,h]pirrolo[1,2-b]isoquinolina | 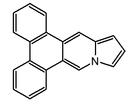 | Ficuseptinas, la criptopleurina y la tiloforina. |
| (6S,11bS)-6,11b-Metano-3a,6,11a,11b-tetrahidrofuro[2,3-c]pirido[1,2-a]azepina | 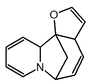 | Securiniaminas, sufruticodina y los securinoles A-D |
| Dibenzo[a,g]-9aH-quinolizina | 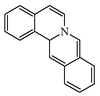 | Protoberberina, anisociclina, palmatina, coripalmina, discretamina, berlambina, lambertina, coreximina, talifaurina, coptisina, escoulerina, estilopina. |
| 6,15-epimino-4H-isoquino[3,2-b][3]benzazocina. | 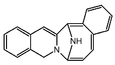 | Saframicina, renieramicina, jorunamicinas |
| (1R,2R,7S,12R,13S,15S)-14-Oxa-6,8-diazapentaciclo[10.6.0.02,7.02,15.08,13]octadecano (Nitraramida) | 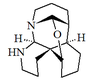 | Nitraramida, nitrabirina |
| 3,5-o-fenilen-2,3,4,5-tetrahidro-1H-2-benzazepina | 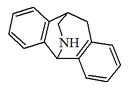 | Amurensina |
| 3,6-Dihidropirrolo[3,2-e]indol | 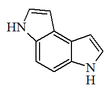 | Duocarmicinas, yatakemicina. |
| 5,11-Epiminodibenzo[a,e][8]anuleno | 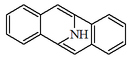 | Pavinas, isopavinas |
| 10H-azuleno[1,2,3-ij]isoquinolina | 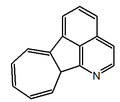 | Imerubrina |
| 5H-Indeno[1,2-b]piridina | 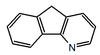 | Oniquina |
| Dibenzo[6,5,4-cd:f]indol | 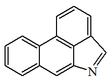 | Cefaronas |
| 5H-Isoindolo[1,2-b][3]benzazepina | 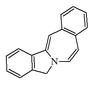 | Lennoxamina |
| Benzo[6,7]ciclohept[1,2,3-ij]isoquinolina | 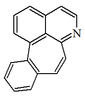 | Kreysigina, |
| 9H-azuleno[1,2,3-ij]isoquinolina | 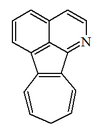 | Grandirubrina |
| Homoeritrinano ([4,5-h]indolo[7a,1-a][2]benzazepina) | 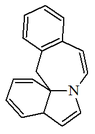 | Schelhameridina, erimelantina, erisopinoforina. |
| Eritrinano |  | β-Erytroidina, Erisotramidina. |
| 3H-ciclopenta[b]pirrolo[1,2-a][3]benzazepina | 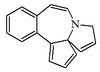 | Cefalotaxina, harringtonina, isoharringtonina, cefalezominas |
| Dibenzo[5,6-a:4',5'-g]-4H-quinolizina | 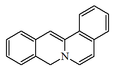 | Cavidina, Talictrifolina, apocavidina, isoapocavidina. |
| Quinolino[2',3':3,4]pirrolo[2,1-b]quinazolina | 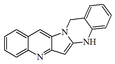 | Luotoninas |
| Benzo[c]fenantridina | 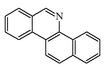 | Quelidonina, sanguinarina, palmatina, queleritrina |
| Benzo[j,k]acridina | 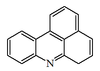 | Necatarona |
| Indolo[3,2-c]quinolina | 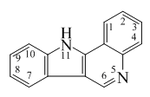 | Isocriptolepina |
Quindolidina | 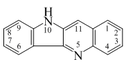 | Quindolidina, Criptolepina |
Quinindolina | 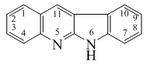 | Neocriptolepina |
| 7H-Indolo[2',3':3,4]pirido[2,1-b]quinazolina | 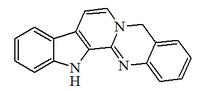 | Evodiamina |
| 5H-indolo[2,3-a]pirrolo[3,4-c]carbazol |  | Arciriaflavinas, estaurosporina |
9H-Quino[4,3,2-de][1,10]fenantrolina |  | Ascididemina |
| 11,22-Diazatetraciclo[11.11.2.12,22.02,12]heptacosane | 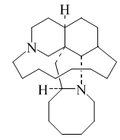 | Ircinales |
Alcaloides de núcleo pirídico: a este grupo pertenecen la nicotina, la pilocarpina y la esparteína.
La nicotina se encuentra en el jugo del tabaco acompañada de otros alcaloides. Es un líquido incoloro, de olor semejante al tabaco y sabor ardiente y picante. Es muy tóxica en dosis altas.
Alcaloides de núcleo isoquinoleico: se encuentran en las plantas papaveráceas y ranunculáceas. El más importante es la papaverina, que tiene propiedades hipnóticas (aunque no tan acentuadas como las de la morfina).
Alcaloides de núcleo fenantrénico: el más importante es la morfina. Se encuentra en el opio en forma de sal. Se emplea en medicina en forma de clorhidrato y sulfato, como sedantes y calmantes.
Alcaloides de núcleo tropánico: pertenecen a este grupo la atropina y la cocaína. La atropina se encuentra en el jugo de varias plantas como la belladona y el estramonio. La cocaína se extrae de las hojas de coca, es de sabor amargo, insensibiliza la lengua, y se usa en medicina en forma de clorhidrato.
Alcaloides de núcleo indólico: los más importantes son la estricnina y la brucina. La estricnina es uno de los alcaloides más enérgicos, se extrae de diversas plantas del género Strychnos, entre ellas el haba de San Ignacio y de la nuez vómica. Es de sabor amargo muy intenso y muy tóxica. su ingestión produce convulsiones tetánicas.
Alcaloides de núcleo no definido: son todos aquellos alcaloides cuya constitución aún no se ha establecido con claridad. Entre ellos se encuentra la aconitina (veneno muy violento, utilizado en terapéutica para combatir ciertas dolencias) y la ergotinina (uno de los principios activos del cornezuelo de centeno, que ejerce una acción específica sobre el útero).
Clasificación por biosíntesis
Los alcaloides se encuentran formando sales con los ácidos acético, oxálico, láctico, málico, tartárico y cítrico. A continuación se mostrará un resumen de la diversidad biosintética de los alcaloides.
Protoalcaloides
Muchos compuestos considerados pseudoalcaloides podrían incluirse en la categoría de protoalcaloides si se consideran todos aquellos que no forman sistemas heterocíclicos. Los más importantes que considerar son las aminas y las amidas.
Aminas
Cuando un aminoácido se descarboxila, se forman las aminas biógenas. La histidina y el triptófano, por poseer de por sí un anillo heterocíclico, serán contemplados en secciones aparte.
Aminoácido precursor | Amina biógena | Estructura |
Glicina | Metilamina | 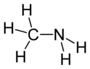 |
Alanina | Etilamina | |
Serina | Etanolamina | |
Cisteína | Cisteamina | |
Ácido aspártico | β-Alanina | 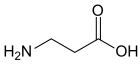 |
Metionina | 4-Metilsulfuro-1-propanoamina | |
Treonina | 1-Amino-2-propanol | |
Ácido glutámico | Ácido γ-aminobutírico (GABA) |  |
Ornitina | Putrescina | |
Arginina | Agmatina |  |
Lisina | Cadaverina | |
Fenilalanina | Fenetilamina |  |
Tirosina | Tiramina |  |
DOPA | Dopamina |  |
Valina | Isobutilamina | |
Leucina | Isoamilamina |  |
Muchas de estas aminas forman derivados posteriores, tales como las catecolaminas. Las efedrinas se forman a partir del ácido benzoico y el piruvato por acción de pirofostato de tiamina.
Muchas aminas pueden aceptar un segundo o hasta tercer grupo alquilo para formar aminas secundarias o terciarias. Cuando un aminoácido forma una sal de trimetilamonio se denomina betaína. Ejemplos de betaínas son la betaína glicínica, la trimetilserina (precursor de la colina) y la hipaforina. La muscarina es una sal de amonio de Amanita muscaria.
Amidas
Las amidas se forman por la conexión heteroatómica de una amina o el amoniaco con una acil-coenzima A.
Guanidinas
Existen aminas que reciben un grupo carbimino de la arginina, tales como la galegina y la creatina.
Alcaloides verdaderos
Poseen siempre un nitrógeno que forma parte de un heterociclo, tienen naturaleza básica, se encuentran normalmente en estado de sal y biogenéticamente proceden de aminoácidos.
Alcaloides derivados de la serina, la cisteína y la glicina

Serina
- La serina forma la cicloserina, una isoxazolidin-5-ona por oxidación intramolecular del nitrógeno.
- La serina puede formar el ácido 2,3-diaminopropiónico (DAP), que a su vez puede formar el ácido quisquálico, un aminoácido no proteínico con un anillo de 1,2,4-oxadiazolidina, aislado de la piscuala. El DAP también forma β-lactamas, las cuales son constituyentes de los antibióticos SP 26.
- La serina puede incorporarse como etanolamina al alcaloide azamacrólido epilacneno.
- En varios péptidos no ribosomales, la serina puede formar oxazoles y estos pueden ser referidos como péptidos alcaloidales. Los oxazoles son el resultado de la ciclación y oxidación de péptidos no ribosómicos de serina o treonina
- En varios péptidos no ribosomales, la serina puede formar oxazoles y estos pueden ser referidos como péptidos alcaloidales. Los oxazoles son el resultado de la ciclación y oxidación de péptidos no ribosómicos de serina o treonina

En donde X = H, Met para serina o treonina respectivamente, B = base.
(1) Ciclización enzimática. (2) Eliminación. (3) [O] = Oxidación enzimática.
Cisteína
La cisteína puede formar diversos tiazoles:
- Un ejemplo es el ácido 2-metil-1,3-tiazol-4-carboxílico. Este ácido tiazólico es la unidad de iniciación de policétidos como las epotilonas.
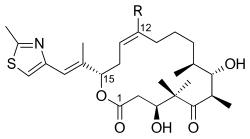 |
Epotilona C |
- Otro ejemplo de tiazoles de la cisteína son los mixotiazoles, los cuales fueron aislados por Höfle y sus colaboradores en los años 70's. El mixotiazol A fue descrito primero en 1978 en una patente y posteriormente fue descrito en los 80's. Los mixotiazoles son 2,4'-bi-1,3-tiazoles aislados de hongos que se forman a partir de un policétido con una unidad de iniciación de cisteína y otra molécula de cisteína.[5]
- La cisteína puede formar también tiomorfolinas en organismos marinos, como la condrina.
Glicina
- La glicina puede formar anillos de imidazol, tales como el AIR y la creatinina.
- A partir de la glicina se forman las bases purínicas guanina y adenina. A partir de la adenina se forman varios compuestos purínicos, como la cordicepina, eritadeninas, nebularina, las citoquininas, cafeína, teofilina, teobromina, malonganenonas y nutinginas.
- A partir de la guanina se pueden sistetizar anillos de isoaloxazina y pteridinas. Muchos insectos pueden producir pigmentos a partir de pteridinas (p. ejemplo Drosofilina, Leucopterina, Drosopterina) u otros anillos derivados:

- La reumitsina y la toxoflavina son compuestos que presentan como esqueleto base la pirimido[5,4-e]-1,2,4-triazina (referidos también como Azapteridinas). Estos compuestos fueron aislados de bacterias del género Actinobacter. Estas triazinas pueden provenir biogenéticamente de una purina o pteridina.
- Ejemplos de azaguanidinas es la zarzisina.
 |
| Pirimido[5,4-e][1,2,4]triazina |
Alcaloides derivados del aspartato
En esta sección se consideran los alcaloides de los aminoácidos biosintéticamente relacionados con el ácido aspártico: aspartato, asparragina, treonina y metionina.
Aspartato y asparagina
El aspartato puede formar otro aminoácido relacionado por reducción del carboxilo terminal y aminación reductiva: el ácido 2,4-diaminobutírico (DABA). Al descarboxilarse puede formar 1,3-diaminopropano. El aspartato puede aceptar un grupo carbamilo por medio de su nitrógeno amino para formar el ácido N-carbamoilaspártico. Además, el ácido aspártico puede condensarse con el fosfato de dihidroxiacetona para formar la vitamina ácido nicotínico.

Pirimidinas: El precursor es el ácido orótico, el cual se forma por heterociclización del ácido N-carbamoilaspártico. Las bases pirimídicas (Uracilo, Timina, Citosina) surgen de este precursor. El ácido barbitúrico es producto del catabolismo de las pirimidinas. Ejemplos de alcaloides que provienen del ácido orótico son la vicina, la convicina, de Vicia faba y la clitocina de Pectinophora gossypiella. La latirina podría ser considerada como un aminoácido no proteínico o un alcaloide debido al anillo de pirimidina. La ectoína es una pirimidina 2-sustituida que no procede de la ruta del ácido orótico sino que a partir del ácido 2,4-diaminobutírico acetilado en el nitrógeno del carbono 4.
Pirazoles: Los anillos de pirazol no son abundantes en la naturaleza, y tienen valor quimiotaxonómico. Un caso es la β-pirazol-1-il alanina y la pirazofurina.
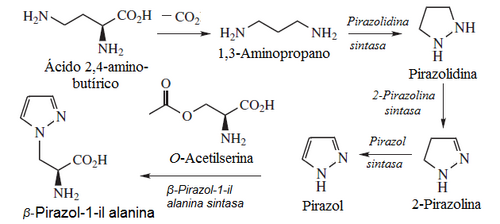
Alcaloides pirido[1,2-a]azepínicos: Se forman en la esponja Niphates digitalis a partir del aldehído subérico y la 1,3-propanoamina (que proviene de la descarboxilación del ácido 2,4-diaminobutírico)[6]

Biosíntesis de alcaloides pirido[1,2-a]azepínicos
Treonina
Se cree que varios aminoácidos no proteínicos con actividad tóxica -como las hipoglicinas, la canalina y la canavalina-, provienen de la treonina.
Metionina
Los metabolitos secundarios nitrogenados de la metionina principalmente consisten en glucosinolatos de la metionina, homometionina y dihomometionina. La goitrina es una 1,3-oxazolidina formada del glucosinolato progoitrina. La S-Adenosil metionina es lo suficientemente reactiva para formar un sistema de azetidina, en forma de ácido azetidin-2-carboxílico, el cual es la base de los isopéptidos conocidos como ácidos mugineicos. Algunas azetidinas se presumen que provienen de este precursor, tales como la 3-azetidinona
y el 3,3-azetidinodiol.
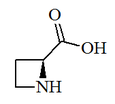 | 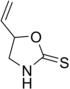 |
| Ácido (S)-(-)-2-Azetidinocarboxílico | Goitrina |
Nicotinato
El ácido nicotínico se forma de novo en las plantas por condensación de una molécula de triosa y una molécula de iminoaspartato (el derivado imino del ácido aspártico), mientras que en animales y hongos se puede formar por catabolismo del triptófano. El ácido nicotínico (ácido piridino-3-carboxílico) es la base estructural de muchos alcaloides piridínicos. El ácido fusárico es un alcaloide piridínico que se forma bajo el mismo principio de condensación pero a partir de aspartato y ácido triacético.
Piridinas: Esta vitamina puede descarboxilarse para dar piridina, hidrogenarse para formar dihidropiridinas u oxidarse. Algunas piridinas relacionadas con el ácido nicotínico son los alcaloides de la palma Areca (Arecolina, guvacina), la ricinina de las semillas del ricino, la hermidina de Mercurialis annua y la trigonelina de la alholva. Varias plantas de la familia Celastraceae producen ésteres del ácido evonínico (ácido nicotínico enlazado con una molécula de ácido 2-metilbutírico) y sesquiterpenos tipo agarofurano. Ejemplos de estos alcaloides son la maytolina, maytina, acantotamina, evonina, neoevonina, euonimina, hipocratinas, emarginatinas.
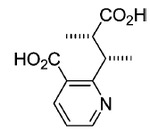 |  |
Ácido evonínico | Estructura general de los alcaloides de Celastraceae. |
Bispiridinas: Las bis-piridinas se forman por acoplamiento de radicales libres (Crisohermidina[7]) o por condensación (Anatabina). Los anillo de piridina se pueden acoplar con otros anillos como en el caso de la nicotina (Anillo pirrolidínico)o anabasina (Anillo piperidínico de la lisina)
 |  |
Crisohermidina | Anatabina |
Hachijodinas: Son hidroxilaminas derivadas de ácidos grasos que se forman cuando el ácido nicotínico es utilizado como unidad de iniciación:[8]
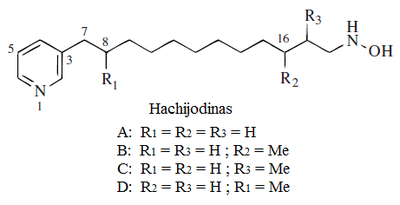
Alcaloides derivados de aminoácidos de la familia del glutamato

Varios alcaloides provienen de los aminoácidos de la familia del glutamato (glutamina, glutamato, prolina, ornitina y arginina.
Glutamato y glutamina
- Cuando la glutamina heterocicliza en sus extremos, forma la glutanimina, la cual tiene un esqueleto piperidínico. Cuando dimeriza forma la indigoidina (Estructura: 1,1',2,2',3,3',4,4'-octahidro-4,4'-bipiridina).
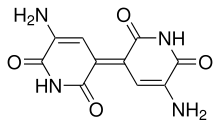
Indigoidina
- El glutamato hidroxilado puede formar un isoxazol de una manera similar a la cicloserina para formar el ácido iboténico, un aminoácido no proteínico con un heterociclo de isoxazol. Este aminoácido es precursor de muchos isoxazoles del hongo Amanita muscaria, tales como el muscimol y el ácido tricolómico.
- El lascivol es una amida de la glutamina y un precursor policétido de los muchos compuestos de estructura indólica, tales como 2,4-dimetilindol, (2-metil-4-hidroximetilindol, (2-metil-4-metoximetilindol y 2,4-dimetil-5-metoxindol
- El lascivol es una amida de la glutamina y un precursor policétido de los muchos compuestos de estructura indólica, tales como 2,4-dimetilindol, (2-metil-4-hidroximetilindol, (2-metil-4-metoximetilindol y 2,4-dimetil-5-metoxindol
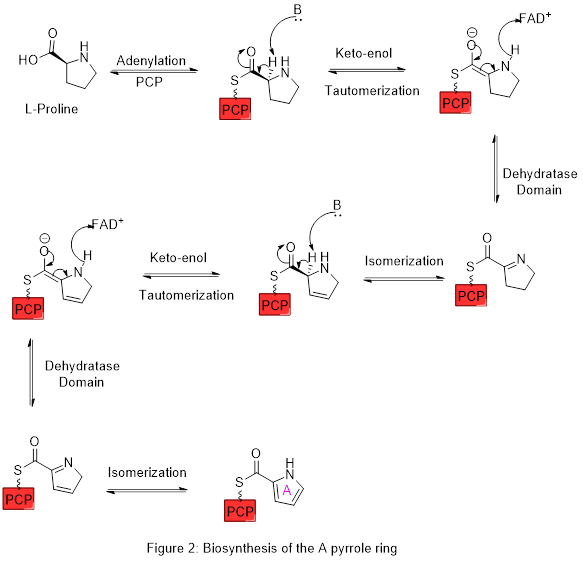
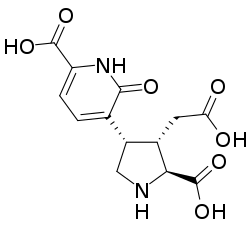
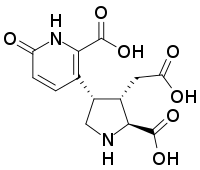
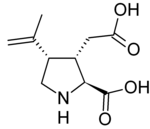
Prolina
La prolina y la ornitina pueden formar alcaloides con núcleo pirrolizidínico; de hecho, la prolina por sí misma es una pirrolizidina. A partir de la prolina se pueden formar:
Ácidos 2-pirrolocarboxílicos así como sus derivados bromados, aislados de esponjas.- La estaquidrina, presente en la betónica, es la betaína de la prolina.
- Antibióticos beta-lactámicos tipo carbapenam.
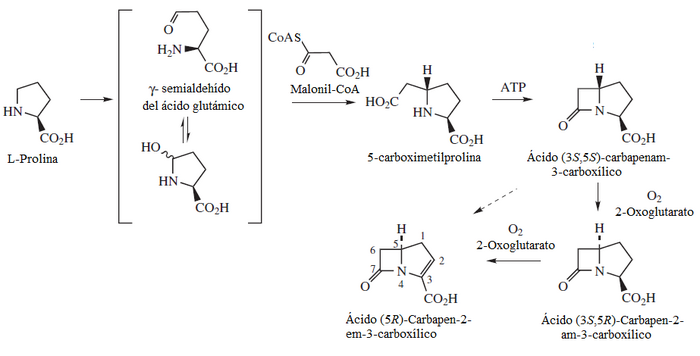
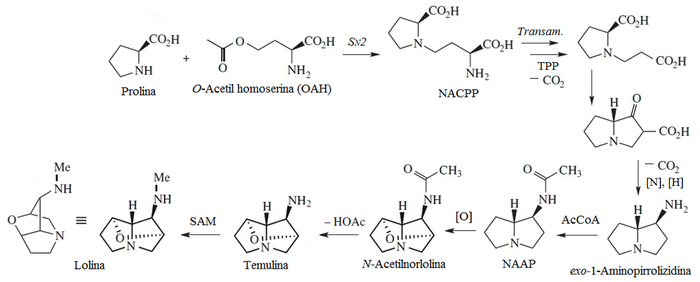
- Muchos hongos clavicipitáceos producen alcaloides con esqueleto de 2-oxa-6-azatriciclo[4.2.1.03,7]nonano, tales como la lolina y la temulina, a partir de prolina y homoserina.
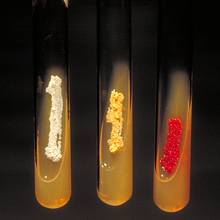
- Las prodigiosinas son pigmentos tripirrólicos producidos por bacterias del género Serratia. El primer anillo de pirrol se biosintetiza por la deshidrogenación de un tioéster de prolina con la enzima:[9][10]
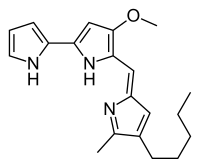
Prodigiosina

Serratia marcescens, bacteria productora de prodigiosinas
Posteriormente, el residuo 2-pirrolcarbonílico se condensa con un nuevo anillo de pirrol de origen tipo policétido:

Ornitina y arginina
La ornitina y la arginina están relacionadas biosintéticamente, ya que la arginina proviene de la ornitina por adición de un grupo carbamilo al nitrógeno terminal de la ornitina con posterior adición de un nitrógeno de aspartato (primeras 3 reacciones del ciclo de la urea)
La ornitina forma alcaloides de dos tipos: los derivados de la putrescina y los derivados de las poliaminas espermina, homoespermina y espermidina
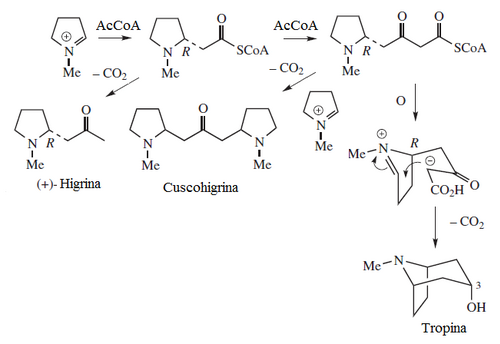
Derivados de la putrescina: La putrescina puede heterociclizar para formar el catión N-metil-Δ1-pirrolinio. Este intermediario metabólico puede incorporarse a muchas rutas tales como:
- a) Formación de 3-pirrolidin-2-il piridinas, como la nicotina
- b) Formación de azaazulenos, tales como la (+)-5-epiindolizidina 167B.
- c) Formación de dos unidades de acetilo: Por el mismo mecanismo de los policétidos (Sólo que la unidad de iniciación es una imina, por lo que en lugar de una condensación de Claisen se lleva a cabo una condensación de Mannich. Así se forman la higrina, cuscohigrina y las dendrocrisaninas. Cuando el derivado tipo policétido heterocicliza forma el esqueleto de tropano. Muchos alcaloides tropánicos se forman en solanáceas y eritroxiláceas, tales como Datura, Atropa,Mandragora y Erythroxylon. Ejemplos de estos alcaloides son cocaína, hiosciamina, tropina, las calisteginas, las esquizantinas, la litorina, meteloidina y escopolamina.
- d) Alcaloides pirrolidinflavonoides: Los anillos de N-metil-Δ1-pirrolinio pueden incorporarse a estructuras de flavonoides. Ejemplos de estos alcaloides son la ficina, la vochisina y la eleocarpina
 |  |
Ficina | Vochisina |
- Las dendrocrisaninas son anillos de pirrolidina con sustituyentes cinamoilo en el nitrógeno.[11]
- La agaricona es un pigmento producido por Agaricus xanthoderma.
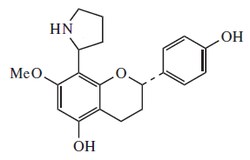
- -Derivados de poliaminas: La homoesperidina puede dar una doble ciclización para producir biosintéticamente alcaloides pirrozilidínicos. Las plantas del género Senecio, la mariposa monarca (Danaus plexippus y otros lepidópteros relacionados (los cuales consumen la planta) y varias orquídeas son los principales productores de alcaloides pirrolizidínicos:[12]
Ejemplos de estos alcaloides son la falenopsina, licopsamina, retronecina, creatonotinas, calimorfina, supidina, rosmarinecina, otonecina, danaiona, traquelantamidina, platafilina, sarracina, hastanecina, crotanecina, heliotridina, platinecina, turneforcidina, ipangulinas y minalobinas.
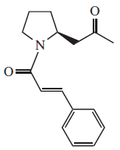
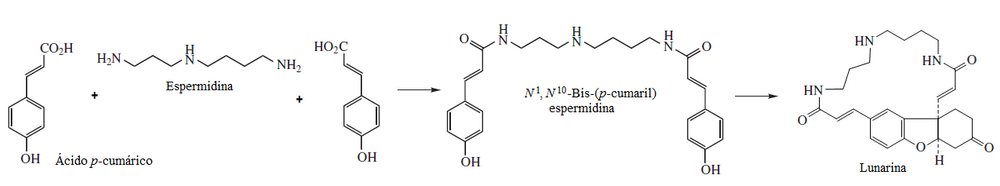
- Muchos alcaloides macrocíclicos provienen de la espermina, como en el caso de la lunarina (Aislada de Lunaria annua[13]):
- La estructura de las motuporaminas sugiere un origen a partir de poliaminas y un ácido graso de cadena mediana:[14]
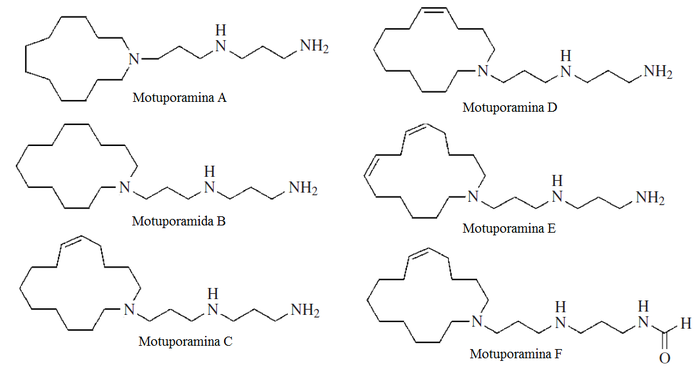
Alcaloides de la Stemona: Las especies de la familia Stemonaceae producen una gran clase de alcaloides diversos estructuralmente relacionados con el núcleo de 4-azaazuleno. Sus raíces han sido utilizadas para el tratamiento de tuberculosis, bronquitis y parasitosis. Ejemplos de estos alcaloides son la estenina, tuberostemonina, estemoamida, estemonina, neostemonina, croomina y estemonidina.
 |  Tuberoestemonina |
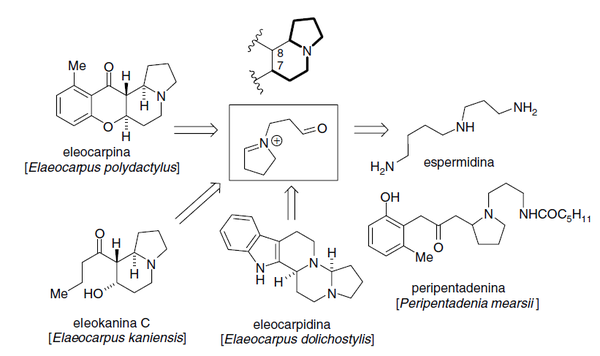
Alcaloides de Elaeocarpus: Las especies del género Elaeocarpus producen una serie de alcaloides indolizidínicos pero a diferencia de los que son tipo swansonina, estos alcaloides se presume que provienen de la espermidina. Se clasifican en:
- - Alcaloides 8-acilindolizidínicos: Como ejemplos se pueden citar a las eleokaninas A-C, grandisinas E y D, la isoelaeocarpicina y la eleocarpenina.
- - Alcaloides tipo eleokanidina: Presentan un esqueleto base de pirrolo[2,1-f][1,6]naftiridina o 1H-pirano[2,3-g]indolizina. Ejemplos de estos alcaloides son las eleokanidinas A-C y las eleokaninas D y E.
- - Alcaloides tipo eleocarpina: Presentan un esqueleto base de 12H-[1]benzopirano[2,3-g]indolizina, como por ejemplo la eleocarpina, la pseudoepiisoeleocarpilina, las grandisinas C y F, la rudrakina, la eleocarpilina, la aloeleocarpilina, epialoeleocarpilina, epiisoeleocarpilina, isoeleocarpilina, epieleocarpilina.
 |  | 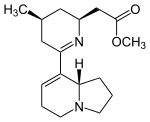 |  |  |
Eleokanina A | Isoeleocarpicina | Grandisina G | Eleokanidina A | Eleocarpina |
Derivados de la arginina: La arginina es precursor de varios productos naturales, tales como el ácido clavulánico, la capreomicidina (una hexahidropirimidina), la tetrodotoxina y las saxitoxinas (Saxitoxina, neosaxitoxina, GTX1-7, C1-C4, dcSTX, dcneoSTX, dcGTX 1-4) las cuales presentan un esqueleto de 1H,10H-pirrolo[1,2-c]purina,[15]

1H,10H-pirrolo[1,2-c]purina, esqueleto base de las saxitoxinas
- Las verpacamidas y la peramida son anhidropéptidos de la arginina y la prolina:

Derivados del porfibilinógeno
El porfobilinógeno es el precursor de los bilanos, porfirinas, corrinas y bilinas. Algunos alcaloides cromóforos producidos por insectos que provienen de este compuesto son la pterobilina, sarpedobilina y la forcabilina.[16]
Alcaloides derivados de la lisina
La lisina puede ser biosintetizada por la ruta del diaminopimelato (DAP) en hongos o por la ruta de α-aminoadipato (AAA). Durante su biosíntesis se pueden formar metabolitos tales como el ácido picolínico y ácido dipicolínico, los cuales son isómeros del ácido nicotínico y el ácido quinolínico, respectivamente.

Cuando la lisina heterocicliza, forma la lactama de la lisina (Esqueleto base: perhidroazepina). Esta lactama es la base de las bengamidas. La alisina el producto de transaminación del amino terminal de la lisina. La desmosina proviene de este intermediario. La alisina puede formar el ácido pipecólico, el cual es un componente de la ascomicina y la rapamicina.
La descarboxilación de la lisina produce la cadaverina, la cual por heterociclización produce Δ1-piperideína. Este anillo puede formar varios sistemas de alcaloides.
Los alcaloides de la lisina se pueden clasificar como derivados de la cadaverina y derivados del pipecolato.
- Los derivados de la cadaverina principalmente son los que proceden de la incorporación de una unidad de piperidina a diversos componentes, por ejemplo:
- - La anaferina, la peletierina y la pseudopeletierina son derivados de acetilación de modo análogo a la biosíntesis de la higrina y los alcaloides del tropano.

- - La estenusina es un derivado por condensación con isoleucina. Otros ejemplos son el ácido evonínico, ácido wilfórdico, el ácido edulínico y la evonina.

Estenusina
- - Alcaloides piperidinflavonoides' Un ejemplo es la rohitukina, las crotacuminas y los derivados de la capitavina.
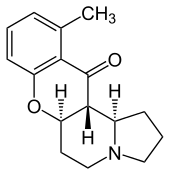
 |  |
Schumannioficina | Rohitukina |
- - Alcaloides 1,3-diazepinflavonoides: Por ejemplo la aquiledina y la isoquiledina.
- - Alcaloides quinolizidínicos: Se forman por dos unidades de piperideína. Se encuentran en varios miembros de la familia Fabaceae. Ejemplos típicos son la lupinina, la lusitanina y la castoramina.
- - A partir de la peletierina y otros derivados se forman nuevos sistemas de anillos heterocíclicos, tales como citisina, esparteína, licodina, angustifolina, albina, fawcetimida, poranterina, cernuina, sofocarpina, criptopleurina, ormosamina, afilina, afilidina, lupanina, retamina, aloperina, baptifolina, multiflorina, camoensidina, matrina, soforidina, soforamina y serratinina.
 |  |  |  |  |  |  |
Esparteína | Citisina | Angustifolina | Licodina | Ormosamina | Fawcetidina | Mirionina |
- - La anabasina, astrofilina y anabatina son bis-piridinas producto de la condensación de Mannich entre otras piperidinas de origen lisínico o nicotínico.

Anabasina
- - La lobelanina, la lobelina y la sedamina se forman por la incorporación de derivados fenilpropanoides.

Lobelina
- - La piperina, la nigramida R, la piperciclobutanamida C y las chabamidas H e I son ejemplos de alcamidas de la piperidina.

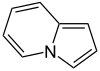
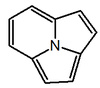
- - Alcaloides indolizidínicos: La castanospermina proviene biosintéticamente del ácido pipecólico. Este se condensa con dos unidades de acetato por medio de condensaciones de Claisen de la misma manera que en los policétidos, generándose así la 1-indolizidinona, la cual es precursora de muchos alcaloides indolizidónicos. Ejemplos de estos alcaloides son la castanospermina, swainsonina, las pumiliotoxinas, la lentiginosina, las poligonatinas y la monomorina. Las mirmicarinas presentan un esqueleto de indolizidina fusionado con un pirrol (Pirrolo[2,1,5-cd]indolizina). Los alcaloides indolizidínicos pueden presentarse fusionados con anillos aromáticos (Dibenzo[f,h]pirrolo[1,2-b]isoquinolina) como en el caso de las ficuseptinas, la criptopleurina y la tiloforina.
 |  |  |
| Indolizina | Pirrolo 2,1,5-cd indolizina | Dibenzo[f,h]pirrolo[1,2-b]isoquinolina |

Alcaloides de litráceas: Estos alcaloides ciclofánicos se componen de un ciclo quinazolínico o piperidínico proveniente de la lisina, los cuales se esterifican con ácidos aromáticos fenilpropanoides o forman éteres entre anillos aromáticos.[17]

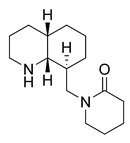
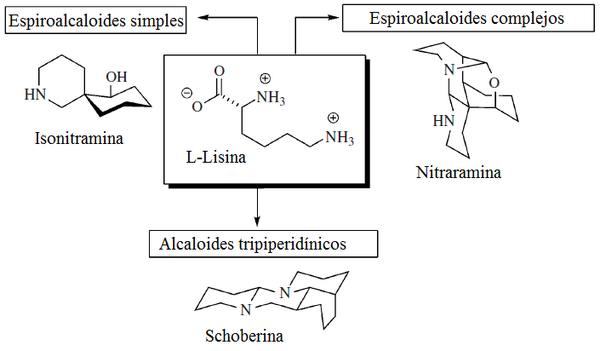
Alcaloides de Nitraria: Gerrit-Jan Koomen y Martin J. Wanner[18] clasificaron los alcaloides de Nitraria, dos de los cuales proceden exclusivamente de la lisina: los espiroalcaloides (Por ejemplo, (+)-nitramina, (-)-isonitramina, (-)-sibirina, nitrabirina, N-óxido de nitrabirina, y sibirinina) y los alcaloides tripiperidínicos (Schoberina, deshidroschoberina, sibiridina y dihidroschoberina)[19]
Ácidos acromélicos: Aislados del hongo Clitocybe acromelalga. Están relacionados biogenéticamente con el ácido kainico y el ácido domoico.[20] Lo que se asegura de todos estos alcaloides es la correlación con el ácido glutámico. El ácido fusárico se condensa en una manera similar, sólo que formando un alcaloide piridínico.
 |  |  |  |  |
Ácido acromélico A | Ácido acromélico B | Ácido kainico | Ácido domoico | Ácido fusárico |
Alcaloides derivados de la fenilalanina y tirosina
La fenilalanina y la tirosina se biosintetizan por la ruta del ácido shikímico, vía corismato, prefenato y arilpiruvatos. Plantas y bacterias sintetizan ambos aminoácidos por rutas separadas, mientras que los animales y los hongos pueden obtener tirosina por hidroxilación de fenilalanina.
Los alcaloides de los aminoácidos tirosina-fenilalanina son un grupo muy amplio y diverso, por lo que serán clasificados por su biosíntesis en los siguientes tipos:
- a) Alcaloides de Securinega
- b) Alcaloides azólicos
- c) Alcaloides isoquinolínicos
- d) Alcaloides mesembrenoides
- e) Alcaloides norbeladínicos
- f) Anhidropéptidos de aminoácidos aromáticos
- g) Alcaloides citocalasánicos
- h) Alcaloides de la ciclo-DOPA
- i) Alcaloides de las seco-DOPAs
Alcaloides de la Securinega
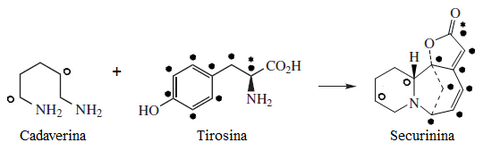
Las plantas del género Securinega producen alcaloides con el esqueleto base (6S,11bS)-6,11b-metano-3a,6,11a,11b-tetrahidrofuro[2,3-c]pirido[1,2-a]azepina. Este pequeño grupo de 30 alcaloides parece provenir biosintéticamente de la tirosina y la lisina, como el caso de la securinina. Otros ejemplos son las securiniaminas, sufruticodina y los securinoles A-D. La filantidina tiene la estructura metanofuro[2,3-d]pirido[1,2-b][1,2]oxazocina. Sankawa y colaboradores dedujeron que la securinina puede provenir de una molécula de tirosina y otra de cadaverina. Los precursores lisina, cadaverina, y tirosina fueron los que mostraron mayor incorporación. Los experimentos de degradación revelaron que la [1,5-14C]-cadaverina marcó específicamente el anillo de piperidina de securinina y la radioactividad de DL-tirosina-[2-14C] fue incorporado en el carbonilo C-11 de la lactona. Los experimentos con L-tirosina[U-14C] y L-tirosina-[3’,5’-³H;U-14C] prueba que el fragmento C6 – C2 es derivado del anillo aromático y los carbono C-2 y C-3 de la tirosina.
[21]
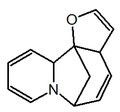 | 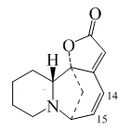 | 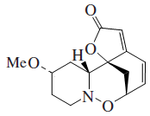 |  |  |
| Securinina | Secuamamina D | Filantidina | Securinega suffruticosa |
Heterociclos formados por ensamblaje
- Los anhidropéptidos de la fenilalanina forman estructuras tipo 2,5-pirazinodiona. Estos metabolitos se encuentran ampliamente distribuidos en hongos. Los anhidropéptidos pueden ser diarílicos (se forman por condensación peptídica de dos arilalaninas, por ejemplo picroroccelina, albonoursina, anhídrido fenilalanínico, ciclopenina, viridicatina, Piperafizina B, emeheterona.
 |  |
Piperafizina B | Picroroccelina B |
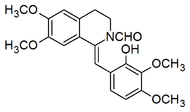
Los anhidropéptidos mixtos (se forman a partir de una arilalanina y otro aminoácido). Por ejemplo, la gliotoxina se forma a partir de la fenilalanina y la serina:

Biosíntesis de gliotoxina
Varios hongos (Arachniotus, Aspergillus, Epicoccum) pueden realizar otras condensaciones y por medio de una electrociclización reversa de un epóxido de areno, se forman alcaloides policíclicos tales como al aranotina. En este caso se lleva a cabo una segunda ciclización, en la que se forma un compuesto policíclico. La aranotina presenta adicionalmente una electrociclización reversa a partir del epóxido de areno correspondiente para forma r un sistema de oxepina.

Biosíntesis de la aranotina
- Otros sistemas de ensamblaje heterocíclico de arilalaninas son las luciferinas de celenterados:
 |  |  |  |
Coelenteramina | Coelenteramida | Coelenterazina | La medusa Aequorea victoria produce coelenteramida como producto de la bioluminiscencia. |
Nocardia es un género de bacterias productoras de vancomicina.
- Diversos aminoácidos modificados son constituyentes de péptidos ribosomales y dépsidos, tales como la vancomicina, la tirocidina y la bauvericina:
 |  |  |
Vancomicina | Tirocidina A | Beauvericina |
Las fenetilaminas pueden incorporarse a anillos de imidazoles (como la la Policarpina) y oxazoles, como la anulolina, el halfordinol, la texalina y la texamina:
 |  |
| Policarpina | Halfordinol |

Luciérnaga común (Lampyris noctiluca)
- Los fenoles simples producto de la degradación de arilalaninas también pueden ensamblarse sin formación de esqueletos de carbono nuevos por condensación intramolecular, formando sistemas heterociclos con dos heteroátomos. Por ejemplo, la luciferina de Lampyris noctiluca se forma por este mecanismo:

Biosíntesis de la luciferina de Lampyris
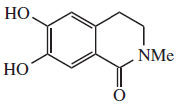
Alcaloides isoquinolínicos
Los alcaloides isoquinolínicos y tetrahidroisoquinolínicos (THIQ) comprenden una diversa gama de compuestos ampliamente distribuidos principalmente en el reino vegetal. Cabe destacar que estas isoquinolinas tienen un sustituyente alquilo en la posición 1. Cualquier otro patrón de sustitución hace pensar en otra ruta biosintética. Biogenéticamente se pueden formar por una Reacción de Pictet-Spengler de una catecolamina con un aldehído o un ácido α-cetocarboxílico:
 | 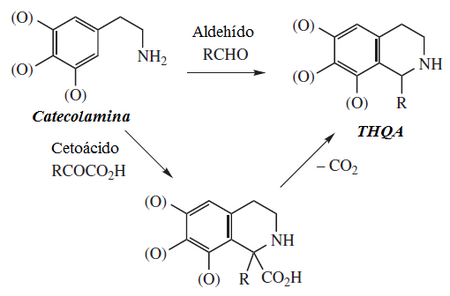 |  |  |  |
| 1,2,3,4-Tetrahidroisoquinolina | Biosíntesis de THIQ.
| Peyote (Lophophora williamsii)
| Cápsula de amapola (Papaver somniferum)
| Las plantas del género Berberis producen alcaloides tipo berberina. |
De acuerdo al aldehído utilizado, se pueden reconocer 4 grandes familias de este tipo de alcaloides:
- a) Las isoquinolinas simples, las cuales se forman por condensación de una catecolamina con acetaldehído, glioxal, piruvato, formaldehído, etc.
- b) La bencilisoquinolinas, que comprenden el grupo más amplio de todos se forman por condensación de una catecolamina con un fenilacetaldehído.
- c) Las fenetilisoquinolinas, que se forman por condensación de una catecolamina con un fenilpropanal.
- d) Los alcaloides tipo ipecósido, en donde el aldehído es un iridoide.
Isoquinolinas y tetrahidroisoquinolinas simples: La isoquinolina se aisló de la planta Spigelia anthelmia (Spigeliaceae). Varios ejemplos son la anhalamina, anhalinina, iseluxina, calicotomina, laudanosina, coridaldina, salsolina, salsolidina, mimosamicina, renierona, talflavina, crispinas.
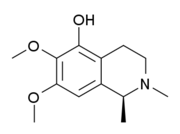 | 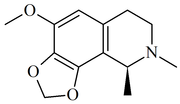 | 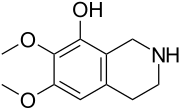 |  |  |  |
Gigantina | Lofoforina | Anhalamina | Dorianina | Iseluxina | Doryphora sassafras
|
- El grupo de la saframicina y la renieramicina presenta la estructura de 6,15-epimino-4H-isoquino[3,2-b][3]benzazocina. Ejemplos de estos alcaloides son las jorunamicinas.

6,15-Epimino-4H-isoquino[3,2-b][3]benzazocina
- - Alcaloides bencilisoquinolínicos y bencilquinolínicos: Se forman por reacción de Pictet-Spengler de una catecolamina con fenilacetaldehídos, provenientes de las rutas de los fenilpropanoides. Ejemplos de estos alcaloides son la papaverina, filocriptina, filocriptonina, velucriptina, papaveraldina y las anocherinas. La arenina y la macrostomina, así como sus derivados poseen adicionalmente un anillo de pirrolidinio acoplado al anillo aromático.

Biosíntesis de benciltetrahidroisoquinolinas
 | 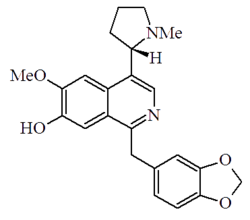 |
Papaverina | Arenina |
- - Alcaloides bisbencilisoquinolínicos: Se producen por acoplamientos de radicales libres y se conectan por medio de uno, dos o tres enlaces éter o bifenilo. Las unidades monoméricas son principalmente bencilisoquinolinas hidroxiladas o metoxiladas. Las aporfinas pueden contener componentes de aporfina. Este gran grupo de alcaloides se pueden dividir en cinco categorías, de acuerdo a la clasificación de Shamma:
- (a) Alcaloides que sólo presentan grupos arilo acoplados. De la corteza de Popowia pisocarpa se han aislado un grupo de 7 alcaloides que presentan enlaces entre C-11 y C-11'. Algunos ejemplos son la pisopowetina y la pisopowiaridina.

Pisopowina
- (b) Alcaloides que contienen sólo un enlace éter: Los enlaces éter comúnmente se encuentran en los carbonos C-11 y C-12', como la dauricina, C-11 y C-10', como en la vanuatina, entre C-10 y C-7' como la malekulatina y la ambrinina, C-11 y C-7', como en la neferina.

Dauricina
- (c) Alcaloides que contienen un enlace con un aromático y uno o dos enlaces éter. Estos alcaloides están basados en el esqueleto de la rodiasina, por ejemplo la tiliacorina.

Rodiasina
- (d) Alcaloides que contienen 2 enlaces éter: El más grande subgrupo simple que contiene dos enlaces éter posee el esqueleto de berbamano, p. ejem. la berbamina. Otro grupo de alcaloides son los del tipo oxiacantano, como la oxiacantina, por ejemplo la oxiacantina, el cual se conecta en los carbonos C-8 y C-7' y entre C-12 y C-13'. Este grupo incluye el talicberano (C-8 a C-6' y C-11 a C-12'), talidasano (C-8 a C-5¢ y C-11 a C-12'), y talmano (C-7 a C-5' y C-11 to C-12'). Todos estos tipos contienen enlaces entre los anillos de bencilo y entre los anillos aromáticos del componente tetrahidroisoquinolínicos. El tubocurarano contiene enlaces éter entre el anillo de bencilo de una unidad y el anillo aromático del componente de isoquinolina de la otra unidad.
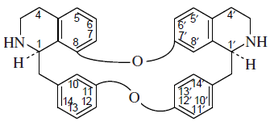 | 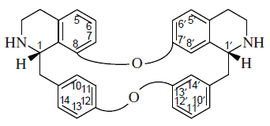 |  | 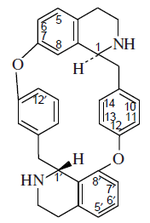 |
| Berbamano | Oxiacantano | Talicberano | Tubocurarano |
- (e) Alcaloides con tres enlaces éter: Estos alcaloides incluyen a los grupos del 6',7-epoxioxiacantano (p. ejem.trilobina), 7,8'-epoxioxiacantano, y 8,12'-epoxitubocurarano.
- - Alcaloides pseudobencilisoquinolínicos: Este término se utiliza para describir un esqueleto de isobenzoquinolina en la cual un esqueleto de bencilisoquinolina en el cual el anillo aromático se encuentra oxigenado en el carbono C-2', C-3' y C-4'. Estos alcaloides provienen biogenéticamente de sales protoberberínicos por la escisión del enlace C8-C8a. La policarpina, canadalina, Taxilamina y Ledecorina son ejemplos de este tipo de alcaloides.
- - Alcaloides cularínicos: Los alcaloides derivados de la cularina ((12aS)-2,3,12,12a-Tetrahidro-6,9,10-trimetoxi-1-metil-1H-[1]benzoxepino[2,3,4-ij]isoquinolina) son tetrahidroisoquinolinas que contienen una oxepina o dihidrooxepina fusionada entre los carbonos C-8 y C-2'. Se forman por un acoplamiento oxidativo intramolecular. Ejemplos son compostelina, sarcocapninas, la gouregina, aristoyagonina, aristocularinas y la cularina.
- - Alcaloides secocularínicos: Se pueden clasificar en dos grupos, las B- y C- secocularinas. Un ejemplo de las β-secocularinas (por ejemplo la secocularina, la secocularidina y la norsecocularina las cuales son estructuralmente relacionadas a alcaloides derivados del fenantreno derivados de aporfinas. Las C-secocularinas (p. ejem. la noyaína).
- - Alcaloides tipo cancentrina: Son dímeros de una unidad de cularina y un morfinano a través de una unión espiro. Se encuentran en especies del género Dicentra.
- - Alcaloides tipo quetamina: Sólo se conocen tres compuestos relacionados: Quetamina, secoquetamina y la dihidrosecoquetamina. Estos alcaloides se encuentran en Berberis baluchistanica.
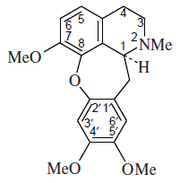 |  |  |  |
Cularina | Policarpina | Noyaína | Quetamina |
- - Alcaloides tipo pavina: Estos alcaloides se forman por modos alternativos de ciclización oxidativa de precursores benzoquinolínicos. P. ejemplo Pavina, argemonina.
- -Alcaloides tipo amurensina: Amurensina
 |  |
Amurensina | Pavina |
- - Benzopirrocolinas: Criptowolidina, criptowolinol, criptowolina.
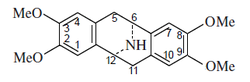
- - Alcaloides proaporfínicos: Este grupo de alcaloides representa una etapa intermedia en la conversión de las bencilisoquinolinas en ciertas aporfinas. Ejemplos de estos alcaloides son la orientalinona, glaziovina, estefarina, mecambrina, pronuciferina.
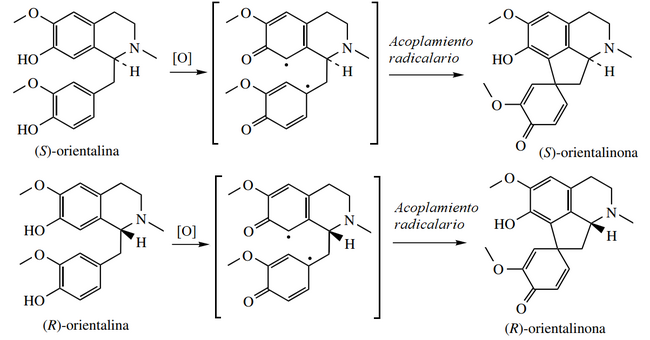
Biosíntesis de proaporfinas
- - Alcaloides aporfínicos:Este gran grupo de alcaloides contiene el sistema de anillo tetracíclico aporfínico (4H-dibenzo[de,g]quinolina)formado por acoplamiento oxidativo de un fenol precursor bencilisoquinolínico.

Biosíntesis de aporfinas. Las aporfinas pueden biosintetizarse por transposición de proaporfinas (1) y por acoplamineto radicalario de una bencilisoquinolina (2).
Las variaciones estructurales incluyen:
- (a) las aporfinas simples y las dioxoloaporfinas, por ejemplo la glaucina, la boldina, la bulbocapnina, la nantenina, la hernandialina, la nuciferina, la liriodenina y la pukateína. Laurotetamina, lauroscolzina, escolina, magnoflorina. También se incluyen derivados de insaturación generalmente entre el carbono C-6a y C-7.
 |  |  |  |
| Esqueleto de aporfina | Glaucina | Bulbocapnina | Nantenina |
- (b) apoporfinoides tipo duguenaína y pancoridina. Su esqueleto base es la 9,10-dihidro-5H,7H-benzo[f][1,3]dioxolo[6,7]isoquino[8,1,2-hij][3,1]benzoxazina.
 |  |
Pancoridina | Duguenaína |
- (c) oxoisoaporfinas (p. ejem. la menisporfina). Presentan la estructura de 7H-dibenzo(de,h)quinolina
- (d) azafluorantenos (p. ejem. la rufescina y la imeluteína). Presentan la estructura de indeno[1,2,3-ij]isoquinolina
- (e) diazafluorantenos (p. ejem. eupolauridina).
- (f) 1-azaoxoaporfinoides (p. ejem. sampangina). Presentan el esqueleto de 7H-Nafto[1,2,3-ij][2,7]naftiridina.
- (g) azahomoaporfinas (p.ejem. la dragabina). Presenta la estructura de benzo[d]-1,3-dioxolo[4,5-g]pirido[4,3,2-jk][2]benzazepina
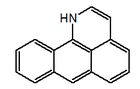 |  | 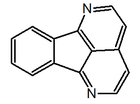 | 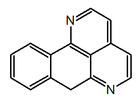 | 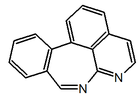 |
| 7H-dibenzo(de,h)quinolina | Indeno[1,2,3-ij]isoquinolina | Eupolauridina | 7H-Nafto[1,2,3-ij][2,7]naftiridina | Benzo[d]-1,3-dioxolo[4,5-g]pirido[4,3,2-jk][2]benzazepina |
- (h) aporfinoides oxidados (p. ejem. Andesina, chiloenina, santiagonamina).
- (i) tropoloisoquinolinas (p. ejm. imerubrina). El esqueleto base es la 10H-azuleno[1,2,3-ij]isoquinolina.
- (j) alcaloides tipo benzo[g]quinolina, por ejemplo la cleistofolina
- (k) alcaloides tipo lennoxamina (Esqueleto base: 5H-[1,3]dioxolo[4,5-h]isoindolo[1,2-b][3]benzazepina)
- (l) alcaloides tipo 5H-Indeno[1,2-b]piridina, por ejemplo la oniquina
- (m) compuestos en los cuales el heterociclo se ha abierto para dar derivados del fenantreno, como por ejemplo la taspina.
- (n) alcaloides que contienen anillos de lactamas de 5-miembros, como las aristolactamas (como la cefaranona A) y la piperolactama. Las cefaronas tienne como esqueleto el benzo[f]-1,3-benzodioxolo[6,5,4-cd]indol. El ácido aristolóquico es un derivado de N oxidación a grupo nitro.
 |  |  |  |  |  |
Santiagonamina | 10H-azuleno[1,2,3-ij]isoquinolina | Benzo[g]quinolina | 5H-Indeno[1,2-b]piridina | Benzo[f]-1,3-benzodioxolo[6,5,4-cd]indol | 5H-[1,3]dioxolo[4,5-h]isoindolo[1,2-b][3]benzazepina |
Dímeros de bencilisoquinolina-aporfina: Tienen un sólo enlace éter. Un caso típico es la talicarpina.
- - Limalongina
- - Alcaloides morfinánicos: Estos alcaloides tienen como esqueleto base al morfinano. Se forman a partir del acoplamiento oxidativo de un precursor isoquinolínico hidroxilado. Algunos ejemplos de este grupo son la codeína, salutarina, morfina y oripavina.
- - Alcaloides tipo hasubanano: Se forman de una manera similar a los morfinanos. Se aislaron de la planta Stephania japonica Hasubanonina, cefaramina, devalaína, glabradina, limalongina, longanina, longeterina, metafanina, miersina, periglaucinas A-D, prometafanina, prostefabisina, prostefanaberrina, runanina, estefabenina, estefadiamina, estefamiersina, estefavanina.
- - Alcaloides tipo 7H-dibenzo[d,f]azonina: Se aislaron de la planta Stephania japonica. Protostefanina.
 |  |
| Hasubanano | 7H-dibenzo[d,f]azonina |
- Alcaloides benzo[c]fenantridínicos:

- - Alcaloides protoberberínicos: Son alcaloides tetracíclicos que tienen como esqueleto base a la protoberberina. Ejemplos de estos alcaloides son anisociclina, palmatina, coripalmina, discretamina, berlambina, lambertina, coreximina, talifaurina, coptisina, escoulerina, estilopina,
cavidina, queilantifolina, corisolidina, coribulbina, coridalidzina, coridalina, coripalmina, corisamina, sinactina, capaurimina. Este grupo de alcaloides comprende:
- (a) tetrahidroprotoberberinas, por ejemplo las tetrahidropalmatinas.
- (b) protoberberinas, como la berberina;
- (c) Derivados metilados en la posición 13 tal como la coridalina
- (d) secoberberinas, las cuales tienen un anillo escindido. Algunos ejemplos son la aobamina, la macrantalina y la macrantoridina.
- - Alcaloides tipo protopina Estos alcaloides tienen el esqueleto base bis[1,3]benzodioxolo[4,5-c:5',6'-g]azecina[22]Protopina, coricavamina, coricavidina, argemexicaínas A y B, constrictosina, criptopina, fagarinas I - III, muramina, pseudoprotopina.
 |
| bis[1,3]benzodioxolo[4,5-c:5',6'-g]azecina |
- - Alcaloides tipo roeadina. El roeadano ([1,3]dioxolo[4,5-h][1,3]dioxolo[7,8]-1H-isocromeno[3,4-a][3]benzazepina) es el esqueleto base de estos alcaloides[23] roeadina, papaverrubinas, alpinigenina, glaucamina, zangezurina.
 |
| [1,3]dioxolo[4,5-h][1,3]dioxolo[7,8]-1H-isocromeno[3,4-a][3]benzazepina |
- - Alcaloides espirobencilisoquinolínicos: Tienen como esqueleto base la 1,2-dihidrospiro[2-H-indeno-2,1'-isoquinolina], por ejemplo la lahorina, africanina, coridaína, coristewartina, fumaricina fumarilinahiperectina, ocotensina, severzinina, radeanamina, radeanina.
 |
| 1,2-dihidrospiro[2-H-indeno-2,1'-isoquinolina] |
- - Alcaloides benzo[c]fenantridínicos:[24] Pueden tener como esqueleto base a la [1,3]benzodioxolo[5,6-c]-1,3-dioxolo[4,5-i]fenantridina o a la bis[1,3]benzodioxolo[5,6-a:4',5'-g]-4H-quinolizina, tales como la Quelidonina, sanguinarina, coridamina, arnotianamida, corinolamina, arnotianamida, quelilutina, corinolina. Dímeros: Sanguidimerina
 |  |
| Bis[1,3]benzodioxolo[5,6-a:4',5'-g]-4H-quinolizina | [1,3]benzodioxolo[5,6-c]-1,3-dioxolo[4,5-i]fenantridina |
- - Alcaloides tipo narceína.[25] Bicuculinina, Peshawarina, narceína.
- - Alcaloides ftalidoisoquinolínicos: α-Hidrastina.
- - Alcaloides fenetilisoquinolínicos
- - Alcaloides homoaporfínicos Tienen como esqueleto base a la benzo[6,7]ciclohept[1,2,3-ij]isoquinolina, p. ejem. kreysigina
 |
| Benzo[6,7]ciclohept[1,2,3-ij]isoquinolina |
- - Alcaloides tipo colchicina: Son aminas de derivados de benzo[a]heptaleno, tales como la colchicina, O-Metilandrocimbina, autumnalina, alcaloide AM 3, colchicilina, colchifolina, cornigerina, lumicolchicinas, demecolcinona, especiosina.
- - Alcaloides tipo homoeritrina: El homoeritrinano es un heterociclo con estructura base de [4,5-h]indolo[7a,1-a][2]benzazepina. Ejemplos de estos alcaloides son schelhammeridina, erimelantina, erisopinoforina, cefalofortuneína, comosina, comosivina, dishomeritrina, fortuneína, holidina, homoerisotina, isofelibilidina, lucidinina, felibilina.
 |
| [4,5-h]indolo[7a,1-a][2]benzazepina |
- - Dibenzocicloheptilaminas: Estos alcaloides han sido encontrados en plantas del género Colchicum y Androcymbium. Por ejemplo la jerusalemina, la salimina, el alcaloide K4 y la colchibifenilina.
- - Alcaloides eritrinánicos β-Erytroidina, Erisotramidina. La cefalotaxina presenta una estructura 4H-ciclopenta[a][1,3]dioxolo[4,5-h]pirrolo[2,1-b][3]benzazepina. La harringtonina y la isoharringtonina.
 |
| Eritrinano |
- Alcaloides tipo aaptamina: La aaptamina y sus congéneres naturales son alcaloides marinos que contienen anillos de 4H-benzo[de][1,6]-naftiridina. Todas las aaptaminas han sido aisladas de Demospongiae (Porifera). Se podrían clasificar estos alcaloides en los siguientes grupos:
- - Derivados de la aaptamina: por ejemplo la aaptamina y la isoaaptamina

- - 1a,3,9-triazapirenos
- - 8H-5,8-diazabenzo[cd]azulenos: Por ejemplo aaptosina y aaptosamina.
- - Dímeros tipo dihouidina
- -Alcaloides tipo lamelarina: Las lamelarinas son una familia de alcaloides pirrolo[2,1-a]isoquinolínicos relacionados con las ningalinas, estorniamidas y lukianoles. Biosintéticamente son alcaloides bencilisoquinolínicos condensados con un fenilpropanoide. Se han aislado más de 30 compuestos relacionados y derivados de las diversas lamelarinas. Las lamelarinas A-D fueron aisladas por Andersen en 1985,[26]
- -Alcaloides espiguetidínicos: Espiguetidina, dragabina.
- Existen diversos oligómeros de isoquinolinas tales como la repandulina, auroramina (p. ejem. la pennsylpavina y la baluchistanamina) y otros alcaloides como la epiberbivaldina y la cancentrina.
 |  |  |
| Cancentrina | Auroramina | Repandulina |
Alcaloides de Isopyrum: Son éteres de una THIQ y una aporfina, por ejemplo la Isopirutaldina, isopitaldina e isotalmidina, talifina e isotalifina.
- - Alcaloides secobisbencilisoquinolínicos: Son aquellos en los cuales una de las unidades de bencilisoquinolina se rompe entre el carbono C-1 y el átomo de carbono α. Se pueden formar así lactamas de aldehídos (como la Punjabina), ésters lactámicos (gilgitina, talcamina) o aminoaldehídos (Jhelumina, chenabina). La karakoramina carece del fragmento de la lactama pero posee una función hidroximetilo en el carbono C'-aromático.
 | 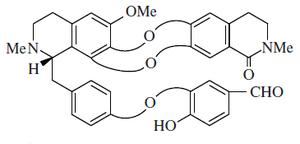 | 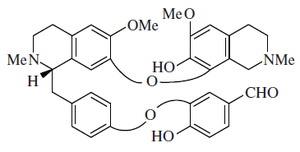 |
Karakoramina | Punjabina | Jhelimina |
Dímeros aporfinoides, tales como la talifaberina, coyhaiquina y hernandalina. Roemeridina y Ourabaína.
Alcaloides tipo emetina: Estos alcaloides forman una unidad de tetrahidroisoquinolina a partir de un aldehído iridoide.El precursor de estos alcaloides es el ipecósido[27] La emetina es el alcaloide típico de este grupo.
Alcaloides tipo ecteinascidina: Trabectidina, ecteinascidinas
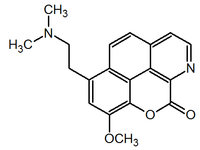
Alcaloides fenantroindolizidínicos y fenantroquinolizidínicos
- - Alcaloides fenantroindolizidínicos y fenantroquinolizidínicos: Tiloforina, Criptopleurina.
Alcaloides norbeladínicos y mesembrenoides
La familia Amaryllidaceae produce un grupo de alcaloides cuyo precursor es la norbeladina, una amina formada por la reducción de la base de Schiff formada entre el aldehído protocatecuico y la tiramina. La norbeladina puede acoplar por radicales libres los dos anillos aromáticos que presenta. Así, pueden formarse distintas estructuras de acuerdo al patrón de acoplamiento de los anillos.[28] Norbeladina, criptostilina I, cherilina, y nivalidina, galantamina, hemantidina, tazetina, y pancracina. Montanina. Licorina, Licorenina. Narciclasina. Principalmente se tienen los esqueletos tipo:
- a) Licorina
- b) Crinina
- c) Galantamina

Los Alcaloides mesembrenoides son derivados de dos unidades de fenilalanina con pérdida de una de las cadenas laterales de etanamina, los cuuales proceden de un intermediario tipo lobeladínico. Este grupo de aproximadamente 20 alcaloides tiene tres tipos estructurales:
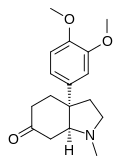
- a) Tipo mesembrina: Tienen el esqueleto base de 3a-feniloctahidro-1H-indol.Mesembrina, mesembrol, crinafolidina.
- b) Tipo joubertiamina: Se forman por la ruptura del anillo de indol, formando así una amina lineal.
- c) Tipo tortuosamina: La amina formada en los alcaloides tipo joubertamina vuelve a ciclar para formar una estructura tipo 6-fenil-5,6,7,8-tetrahidroquinolina.
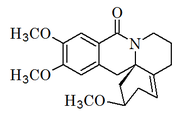
Alcaloides dibenzoquinolizínicos y dibenzoindolizínicos
Constituye una pequeña familia de alcaloides que constan de un residuo aromático proveniente de un derivado de un arilpropano y un ciclo condensado, formado probablemente como las cilindrinas. Han sido aisladas de las plantas menispermáceas Cocculus hirsutus[29][30][31]
 |  |
Cohirsina | Cohirsitinina |
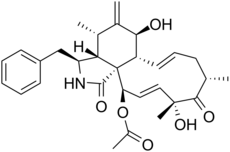
Citocalasinas y pseurotinas
Las citocalasinas son alcaloides policétidos que consisten en una amida del extremo carboxílico del policétido con el grupo amino de la fenilalanina. Posteriormente este sistema condensa para formar una pirrolona y posteriormente se presenta una reacción de Diels Alder intramolecular.
Las pseurotinas son alcaloides policétidos espirofuropirrólicos producidos por un policétido precursor que forma una amida con la fenilalanina. Posteriormente se forma la heterociclización del pirrol y al final la espirolactama con oxidaciones posteriores. Las cefalimisinas son alcaloides con biosíntesis relacionada a las pseurotinas.
Alcaloides de la ciclo-DOPA
La dihidroxifenialanina (DOPA) puede formar el 2,3-dihidroindol denominado cicloDOPA. Este compuesto puede formar indoles intermedios. Cuando este compuesto polimeriza, se cicla o se condensa con cisteína forma las eumelaninas y las feomelaninas.

Alcaloides de la seco-DOPA
Betalaínas.La base de estos pigmentos alcaloides es el ácido betalámico, el cual se forma por la escisión oxidativa de la DOPA. Cuando el ácido betalámico forma iminas con el nitrógeno de los aminoácidos, se forman las betalaínas. Se clasifican en dos tipos: las betacianinas, que son sales de iminio de la cicloDOPA, y las betaxantinas, que son iminas con aminoácidos o aminas biógenas. Estos metabolitos secundarios de las plantas nitrogenados actúan como pigmentos rojos y amarillos. Están presentes solamente en el taxón Caryophyllales excepto Caryophyllaceae y Molluginaceae (Clement et al. 1994[32]). En contraste, la mayoría de las demás plantas poseen pigmentos que son antocianinas (que pertenecen al grupo de los flavonoides). Las betalaínas y las antocianinas son mutuamente excluyentes, por lo que cuando se encuentran betalaínas en una planta, estarán ausentes las antocianinas, y viceversa. Algunos hongos también presentan estos compuestos, llamados muscaaurinas. Cuando en lugar de formar un heterociclo de seis miembros (como el caso del ácido betalámico) se forma uno de siete, se denomina muscaflavina, y las iminas se denominan higroaurinas.[33]
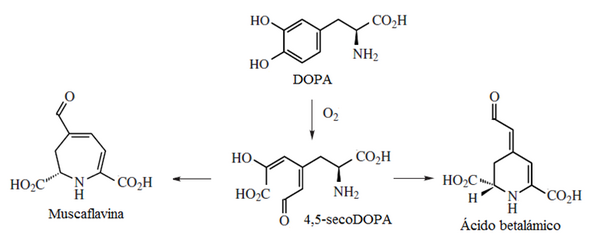
Alcaloides derivados del antranilato
El ácido antranílico se forma por eliminación concertada con una adición de un nitrógeno de la glutamina del ácido corísmico. Este compuesto es el precursor de múltiples metabolitos secundarios, los cuales pueden ser clasificados en las siguientes categorías:
- a) Protoalcaloides del antranilato.
- b) Alcaloides fenazínicos
- c) Policétidos mixtos con ácido antranílico
- d) Alcaloides quinazolínicos
- e) Alcaloides indólicos
- f) Alcaloides β-carbolínicos
- g) Alcaloides del ergot
- h) Anhidropéptidos del triptófano
- i) Dímeros del triptófano
- j) Derivados de la quinurenina
- k) Alcaloides quetoglobosánicos

Metabolitos del antranilato
Protoalcaloides del antranilato
- Protoalcaloides del ácido antranílico: Damascenina
- Dímeros del ácido antranílico: Bleniona, lilacinona
- 2H-Benzo[c]pirano[2,3-h]cinolinas: Necatorina
- Protoalcaloides del ácido antranílico: Damascenina
Alcaloides fenazínicos
Alcaloides fenazínicos: piocianina, aeruginosinas, esmeraldinas.

La piocianina es un alcaloide fenazínico que constituye una de las muchas toxinas producidas y secretadas por la bacteria Gram negativa Pseudomonas aeruginosa. La piocianina es un metabolito secundario de coloración azul con la capacidad de oxidar y reducir otras moléculas y, por lo tanto, puede matar a los microbios que compiten contra P. aeruginosa así como a las células de los pulmones de los mamíferos a los cuales P. aeruginosa ha infectado durante la fibrosis quística. El ácido corísmico es el precursor de la piocianina, en la que se forma un intermediario aminado que al ensamblarse con dos unidades tautoméricas distintas, genera el ácido fenazino-1-carboxílico. Este compuesto es precursor de otras fenazinas.[34]

- Alcaloides 1,4-benzoxazin-3-ónicos: DIMBOA
- Alcaloides 1,4-benzoxazin-3-ónicos: DIMBOA
Policétidos mixtos con ácido antranílico
- Quinolonas y furo[2,3-b]quinolinas: equinopsina, dictamnina, platidesmina, flindersina, eskimianina, cusparina
- Alcaloides acridínicos: xantevodina, 4-hidroxi-2-quinolona, melicopicina, acronicina, rutacridona.Acrimarina.
- Quinolonas y furo[2,3-b]quinolinas: equinopsina, dictamnina, platidesmina, flindersina, eskimianina, cusparina

- Alcaloides quindolínicos: Criptolepina 10H-Indolo[3,2-b]quinolina (Quindolina), criptospirolepina, criptolepinas, isocriptolepina, neocriptolepina, hidroxicriptolepina, criptoheptina, biscriptolepina, criptomisrina y criptoquindolina.
- Alcaloides carbazólicos: murrayafolinas, mukonina, koenolina, 3-metilcarbazol, clausinas, 1-hidroxi-3-metilcarbazol, ácido mukoeico, glicozolina, girinimbinol, furostifolina, clauszolinas, mahanimbinol, murrastifolinas, carbazomicina, koeniginaquinonas, Carbazomadurinas

Alcaloides quinazolínicos
- Alcaloides quinazolínicos y pirrolo[2,1-b]quinazolinas: Vasicina, luotonina, febrifuguina, triptoquivalina.Macrorina.
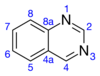
- Dictioquinazoles
- Alcaloides benzodiazepínicos: Ciclopenina, viridicatina.
Alcaloides indólicos
- Alcaloides indólicos e isatínicos: Provienen del indol o el triptófano como las Auxinas, glucobrassinina, escatol, triptamina, serotonina, indol, indoxilo, isatina, camalexina, 5-(3’-metilbuten-2’-il)isatina, melosatinas, hipaforina, bufotenina, plakohipaforinas, bromoindoles, Indolmicina, Sinalexina, Mitomicinas, Petromindol, Brasilidinas, Dilemaonas, 5-MeO-DMT, ésteres del triptofol, 1-(2-metilbut-3-en-2-il)-1H-indol-3-carboxilato de metilo y el 1-(3,4-dihidroxi-2-metilbutan-2-il)-1H-indol-3-carboxilato de metilo.[35]

- Alcaloides pirimidilindólicos: Meridianinas, psamopeminas, isomeridianinas
- Alcaloides pirimidilindólicos: Meridianinas, psamopeminas, isomeridianinas

- Alcaloides pirroloindólicos: Se forman por heterociclización de la triptamina para formar 1,8-dihidropirrolo[2,3-b]indoles tales como la Quimonantina, fisostigmina, flustraminas.
 |
| 1,8-dihidropirrolo[2,3-b]indol |
- Necataronas
 |
Necatarona |
Alcaloides β-carbolínicos
- β-carbolínas simples: Se forman por condensación con formaldehído, piruvato, acetaldehído, etc.

β--Carbolina, Harmano, eleagnina, harmina, harmalina, Pseudofrinaminas A, 5-Bromo-6-hidroxi-β-carbolina, pseudofrinaminol, perlolirina, borrerina, eudistominas, cantin-6-ona, infractinas, flazina, cantinonas.
Picrasidinas: Bis-β-carbolinas producidas por condensación de triptamina con adipaldehído.
Eudistominas: Grupo de alcaloides que condensan con cisteína aislados de tunicados:- Carbolinas fusionadas con antranilato: Evodiamina
 |  |  |  |
β-Carbolina | Harmina | Eudistomina C | Evodiamina |
- Alcaloides pirrolo[4,3,2-de]quinolínicos: Indoloquinonas con ciclización intramolecular de un enlace imino que forman estructuras de pirrolo[4,3,2-de]quinolina. Ejemplos: Makaluvaminas y micearrubinas.[36] Las sanguinonas tienen otros 2 anillos fusionados, al igual que las hetatopodinas
 |  |  |
| Pirrolo[4,3,2-de]quinolina, estructura base de las makaluvaminas | Sanguinona A | Hematopodina |
Infractopicrinas: Alcaloides pentacíclicos aislados de Cortinarius infracta.
 |
Infractopicrina: |
- Alcaloides indólicos de Nitraria: Se forman por la condensación de un anillo hidrolizado de piperideina proveniente de la lisina (Alcaloides β-carbolinmonopiperideínicos) o con dos unidades de piperideina (Alcaloides β-carbolindipiperideínicos). Ejemplos de estos alcaloides son la nazlinina, schobericina, komaroidina, las komavinas, nitrarina, nitramidina, nitraricina, nitrarizina, tangutorina, nitraraína, komarovina, komarovicina, komaroína, komarovidina, isokomarovina, nitramarina
- Alcaloides indólicos de Nitraria: Se forman por la condensación de un anillo hidrolizado de piperideina proveniente de la lisina (Alcaloides β-carbolinmonopiperideínicos) o con dos unidades de piperideina (Alcaloides β-carbolindipiperideínicos). Ejemplos de estos alcaloides son la nazlinina, schobericina, komaroidina, las komavinas, nitrarina, nitramidina, nitraricina, nitrarizina, tangutorina, nitraraína, komarovina, komarovicina, komaroína, komarovidina, isokomarovina, nitramarina
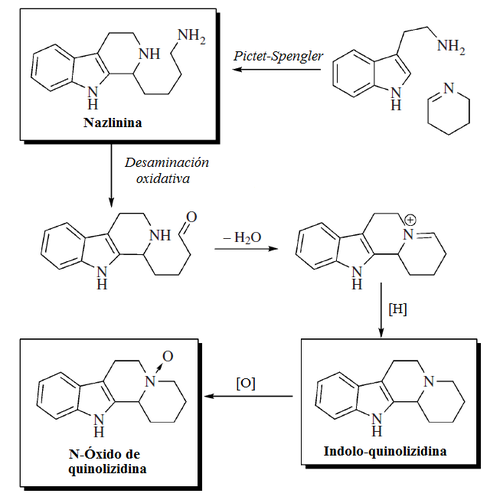
- Alcaloides estrictosidínicos: Estrictosidina
- Alcaloides estrictosidínicos: Estrictosidina

- Alcaloides tipo camptotecina: Presentan anillos de (1H,4H,12H)-pirano[3',4':6,7]indolizino[1,2-b]quinolina como la Rubescina, camptotecina.
 |
| (1H,4H,12H)-pirano[3',4':6,7]indolizino[1,2-b]quinolina |
- Alcaloides indoloquinolizidínicos: Angustina, Deplancheína
- Alcaloides indoloquinolizidínicos: Angustina, Deplancheína
 |
Angustina |
- Alcaloide tipo Corynanthe: Geissosquizina, sitsirikina, Ocrolifuaninas, Usambarinas
 |  |
Geissosquizina | Ocrolifuanina A |
- Alcaloides tipo Ajmalicina: Ajmalicina, oxayohimbano, corinanteína
- Alcaloides tipo Ajmalicina: Ajmalicina, oxayohimbano, corinanteína
 |  |  |
| Corinano | Oxayohimbano | Ajmalicina |
- Alcaloides oxindólicos: Rincofilina, Formosanina
- Alcaloides oxindólicos: Rincofilina, Formosanina
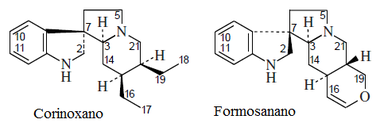
- Alcaloides de Gelsemium: Gelsedina, gelsemina
- Alcaloides de Gelsemium: Gelsedina, gelsemina

- Alcaloides yohimbinoides: Yohimbina, reserpina, Alstonilina, rescinamina.
- Alcaloides tipo Akuammilina: Akuammilina, equitamina, eripina, aspidodasicarpina, alstofilina, narelina,
 |  |
| Akuamilano | Macrolina |
- Alcaloides tipo sarpagina: Sarpagina, vobasina, gardneramina, ervatamina, ervitsina y koumina.Ervatamina, tabernaemontanina
- Alcaloides tipo sarpagina: Sarpagina, vobasina, gardneramina, ervatamina, ervitsina y koumina.Ervatamina, tabernaemontanina
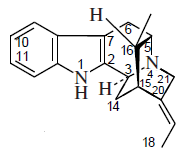 |  | 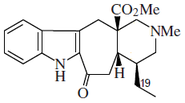 |
| Sarpagano | Akuamidina | Ervatamina |
- Alcaloides tipo ajmalano: Perakina, Raucaffrinolina, ajmalina
- Alcaloides tipo ajmalano: Perakina, Raucaffrinolina, ajmalina
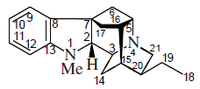
- Alcaloides tipo pleiocarpamina: Pleiocarpamina
- Alcaloides tipo pleiocarpamina: Pleiocarpamina
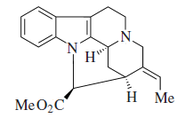
- Alcaloides tipo cincona: Este grupo de alcaloides incluye el antimalárico quinina, y contienen un anillo de quinuclidina. Este grupo se clasifica en dos grupos:
Quinina, cinconamina
(a) el grupo de la cinconamina, derivado de un precursor tipo corinantina por fisión de N-4 al enlace C-5, y por unión de N-4 a C-17,
(b) el grupo de la quinina, el cual contiene un anillo de quinolina generado por la fusión de los enlaces 2,7 seguido de una fusión de N-1 a C-5 del cinconaminal.

 |  |
Cinconamina | Quinina |
- Alcaloides tipo estricnina: Se forman a partir de la akuammicina y sufren una posterior condensación aldólica con una unidad de acetil coenzima A. Algunos ejemplos son la Estricnidina, prekuamicina, brucina, estemadenina, estricnina.
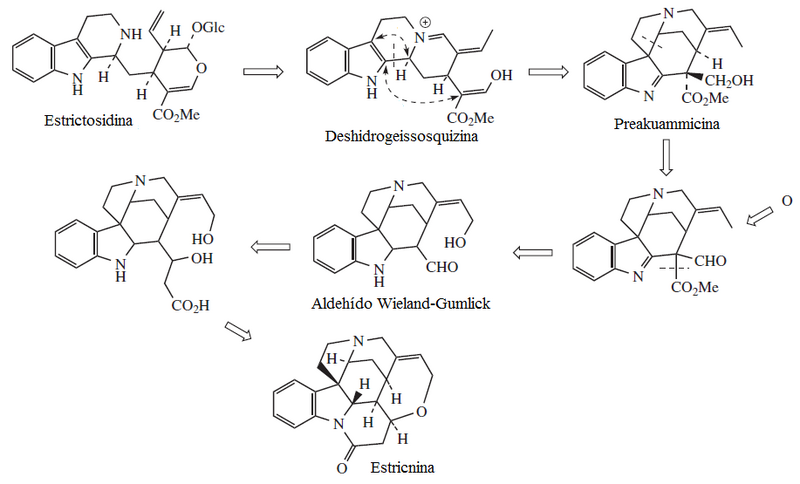
- Alcaloides condilofolánicos: Condilocarpina, goniomina
- Alcaloides condilofolánicos: Condilocarpina, goniomina

- Alcaloides tipo goniomina: Goniomina
- Alcaloides tipo goniomina: Goniomina
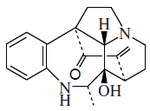
- Alcaloides secodínicos: Secodina y andranginina.

- Alcaloides ibogamínicos: Consiste en una serie de alcaloides que provienen de la fisión de la prekuamicina, en donde se forma la estemadenina y por reacción de Dielsa-Alder se forma un nuevo anillo de ibogamina.

Ejemplos de estos alcaloides son la Catarantina, coronaridina, tabernoxidina.
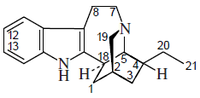 |
| Ibogamina |
- Alcaloides aspidospermidínicos:[37] El esqueleto de los alcaloides aspidospermidínicos se forma por ciclización de la deshidrosecodina, obtenida de un precursor de deshidrosecodina.P. ejemplo la eburenina.

Los alcaloides de este grupo incluyen las siguientes variantes estructurales:
- (a) alcaloides anilinoacrílicos, tales como la tabersonina, el cual contiene el grupo metoxicarbonilo en el carbono 16. Los dos sustituyentes de carbono en la posición 20 pueden ser un simple grupo etilo, o pueden estar funcionalizados.

Tabersonina
(b) alcaloides que carecen del grupo metoxicarbonilo del carbono 16, como en la aspidospermina. C-18 y C-19 pueden ser un grupo etilo o C-18, el cual puede estar funcionalizado.

(c) alcaloides que contienen un puente éter o lactona entre C-18 y C-21;
(d) alcaloides que contienen un puente éter o lactona entre C-18 y C-15;
(e) alcaloides que contienen un puente lactona entre C-18 y C-17, y un anillo de dihidro-1,4-oxazina entre N-1 y C-12, como en la obscurinervidina:
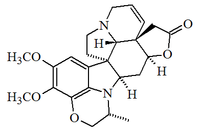 |
Obscurinervidina |
(f) alcaloides que contienen un enlace adicional entre C-18 y C-2, como en la venalstonina;
 |
Venalstonina |
(g) alcaloides que contienen un enlace adicional entre C-19 y C-2, como en la vindolinina;
 |
Vindolinina |
(h) el grupo de la quebrachamina, la cual es derivada de la fisión del enlace 7,21. Estos alcaloides pueden haber perdido el grupo metoxicarbonilo del C-16 como en la quebrachamina o puede conservarse, como en la vincadina. Ejemplos de estos alcaloides son kopsiyunaninas.
 | 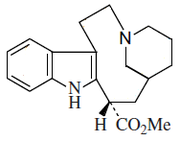 |
| (+)-Quebrachamina | Vincadina |
(i) Dímeros tales como la vinblastina, la vinorebina y la vincristina. (V. Alcaloides de la vinca)
(j) alcaloides diversos formados por una gran variedad de procesos, p. ejem. aspidodispermina, banucina, vincatina, razinilama, tricofilina, meloscina, melonina, goniomitina
- Alcaloides kopsánicos: Kopsina, Fruticosina
- Alcaloides kopsánicos: Kopsina, Fruticosina

- Alcaloides tipo lapidilectina y lundurina.
 |  |
Lapidilectina B | Lundurina B |
- Alcaloides tipo pandolina: Pandolina, Cleavamina, Pandina, Iboxifilina, Ibofilidina
- Alcaloides tipo pandolina: Pandolina, Cleavamina, Pandina, Iboxifilina, Ibofilidina

- Alcaloides piridocarbazólicos: Estos alcaloides se forman por la escisión de la estemadenina y por ciclización sobre el anillo de indol. Ejemplos de estos compuestos son la Olivacina, Elipticina, guatambuina, janetina
- Alcaloides piridocarbazólicos: Estos alcaloides se forman por la escisión de la estemadenina y por ciclización sobre el anillo de indol. Ejemplos de estos compuestos son la Olivacina, Elipticina, guatambuina, janetina

- Alcaloides tipo uleína-dasicarpidano: Ngouniensina, vallesamina, uleína
- Alcaloides tipo uleína-dasicarpidano: Ngouniensina, vallesamina, uleína
- Alcaloides tipo conofilidina.

- Alcaloides de Eburna: Eburnamina, cuanzina, Equizozigina, Andrangina y Vallesamidina
- Alcaloides de Eburna: Eburnamina, cuanzina, Equizozigina, Andrangina y Vallesamidina
El esqueleto de estos alcaloides se generan por transposición del sistema de aspidospermidina, por migración del carbono 21 desde el carbono 7 al carbono 2, fisión del enlace 2,16 y por unión de C-16 a N-1.
Estos alcaloides se pueden clasificar en:
(a) Vincamina y sus derivados, los cuales retienen el grupo metoxicarbonilo;
(b) los alcaloides como la eburnamina y la eburnamenina, el cual tiene una pérdida del grupo éster en C-22;
(c) algunos derivados en donde C-18 o C-19 son oxidados como la cuanzina;
(d) El grupo de la esquizozigina, el cual contiene un enlace adicional entre C-2 y C-18;
(e) Alcaloides relacionados andrangina y vallesamidina, en donde C-21 ha migrado a C-2.
 |
Eburnamenina |
- Alcaloides tipo manzamina
Alcaloides del ergot y otros indolterpénicos
- Alcaloides ergolínicos: Chanoclavinas, elimoclavina, ácido ciclopiazónico, ergocristina, ergometrina, ergoclavina, ácido clavicipítico, ácido lisérgico, ergina, agroclavina, ácido paspálico, elimoclavina, ergocornina.
- Alcaloides tipo Lolitrem: Lolitrem
- Alcaloides tipo Lolitrem: Lolitrem

- Ácido nodulispórico
- Lolicinas
- Alcaloides indolo[2,3-a]carbazólicos:
Hapalindoles: Indoles prenilados aislados de Cyanophyta.
 |
Hapalindol A |
- Alcaloides de Aristotelia: Aristotelina
- Alcaloides de Aristotelia: Aristotelina
 |
Aristotelina |
- Alcaloides de Borreria: Borrecapina, borrelina, borreverina.
 |
Borrecapina |
- Alcaloides tipo notoamina
- Alcaloides tipo notoamina
Dímeros del triptófano

Estaurosporina
- Alcaloides tipo Caulerpa: Caulerpina
- Alcaloides indoloflavonoides: Lotthanongina
- Alcaloides tipo arciriaflavina y estaurosporina
- Peroforamidinas
- Asterriquinonas
- Alcaloides tipo Caulerpa: Caulerpina
Alcaloides derivados de la quinurenina
Quinurenina, Ácido xanturénico, ácido quinurénico, Orellanina

- Alcaloides fenoxazínicos: Cinabarina, ácido cinabarínico, tramesanguina, polistictina, fenoxazona, α-aminofenoxazona. Son alcaloides típicos del hongo Pycnoporus.

- Alcaloides tipo dercitina y ciclodercitina. Kuanoniaminas.
Anhidropéptidos del triptófano
- Anhidropéptidos del triptófano, espirodesminas, imidazoloides y almazolonas:espirodesminas, almazolonas, equinulina, brevianamidas, roquefortina, verruculógeno, oxalina, indolactamas, esporidesminas, aranotina, hamacantinas, espongotinas, topsentinas, hirtadina, tardioxopiperazinas.
- Alcaloides indolil morfolínicos: oxazininas..
- Alcaloides tipo 4-fenil-[2,7]-naftiridina: Algunos ejemplos son las lofocladinas.
Alcaloides quetoglobosánicos
Quetoglobosanos y esqueletos relacionados: Alcaloides policétidos con una unidad de triptófano esterificada y modificada por una cicloadición de Diels-Alder. Incluye a las quetoglobosinas, proquetoglobosinas, isoquetoglobosinas, penocalasinas y citoglobosinas.
Alanditripinona, Alantrifenona, Alantripineno, Alantrileunona
Alcaloides derivados de la histidina
- Alcaloides imidazólicos
- - Alcaloides derivados de la histidina: Histamina, ácido urocánico, murexina, diftamida, ergotionina
- - Alcaloides del Jaborandi: Por ejemplo la pilocarpina, dolicotelina y pilosina
- Alcaloides clatrodínicos
- - Amidas tipo clatrodina

- - 6,8-dihidropirimido[4,5-c]pirrolo[3,2-e]azepinas: Latonduinas
- - Alcaloides tipo agelaspongina y fakelina
- - Alcaloides tipo agelastatina
- - Dímeros de clatrodinas:
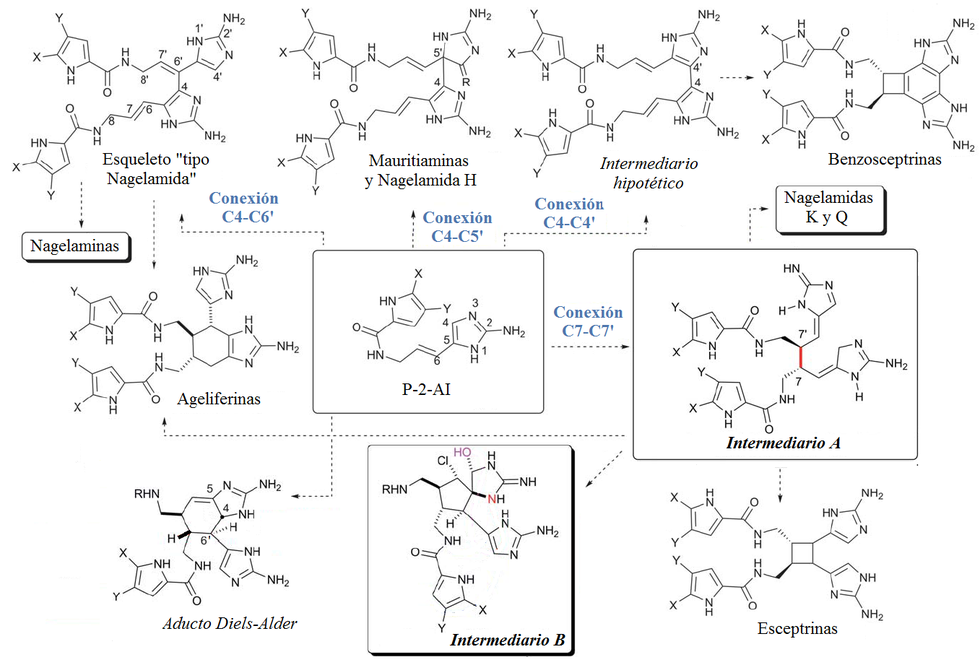
- (a) Alcaloides tipo agelamida
- (b) Alcaloides tipo ageliferina
- (c) Alcaloides tipo esceptrina
- (d) Alcaloides tipo estilisazol
- (e) Policiclos de la macrofakelina:: Por ejemplo la palauamina, la masadina, axinelamina y la estiloguanidina.
Alcaloides derivados de los aminoácidos ramificados
Pirroles: Ácido tenuazónico

Pirazinas: Ácido aspergílico, flavacol, ácido pulcherímico, ácido neoaspergílico

Biosíntesis propuesta para el ácido pulcherrímico
- Sarcodoninas
Genalcaloides
Los genalcaloides -u óxidos aminados de alcaloide- son derivados por oxidación de los alcaloides que contienen el grupo R=(NO)-R, donde el nitrógeno tiene valencia V, en contraposición a los alcaloides normales, donde es trivalente (R=N-R). Su acción es la misma que la del alcaloide del cual provienen, pero es más pausada. Se nombran añadiendo el prefijo gen- al nombre del alcaloide.
Algunos genoalcaloides se encuentran en la naturaleza, como la geneserina (derivado del alcaloide eserina (fisostigmina)) presente en el haba de Calabar, así como las sarcoviolinas y sarcodoninas.
Pseudoalcaloides
Los pseudoalcaloides son metabolitos secundarios que poseen un átomo de nitrógeno incorporado como amoniaco a una biomolécula tal como un terpeno, un policétido, un ácido graso o un derivado del ácido shikímico.
Quimiotaxonomía
Se han encontrado alcaloides en gimnospermas como Cycas, Pinus, Ephedra y Podocarpus. Se han aislado alcaloides de muchos sistemas vivos distintos a las plantas, como Bacterias, cnidarios, esponjas, hongos verdaderos, vertebrados y artrópodos.
Alcaloides de bacterias y arqueas
Phylum Proteobacterias | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
| Beta Proteobacteria | Neisseriales | Familia Neisseriaceae:
| 
|
Burkholderiales | Familia Oxalobacteraceae:
Familia Burkholderiaceae:
| 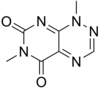 Toxoflavina | |
| Gamma Proteobacteria | Pseudomonadales | Familia Pseudomonadaceae:
| 
|
Enterobacteriales | Familia Enterobacteriaceae: Trispirroles tipo Prodigiosinas (Serratia) | 
| |
| Delta Proteobacteria | Myxococcales | Familia Polyangiaceae:
|  Epotilonas A (R = H) y B (R = CH3) |
Phylum Cyanobacteria | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Cyanophyceae | Nostocales | Familia Nostocaceae:
|  Anatoxina A |
Oscillatoriales | Familia Noctuoidea:
Familia Phormidiaceae:
|  Saxitoxina | |
Stigonematales | Familia Mastigocladaceae:
|  Hapalindol A | |
Phylum Actinobacteria | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
| Actinobacteria | Actinomycetales | Familia Pseudonocardiaceae:
Familia Actinomycetaceae:
Familia Streptomycetaceae: Se han aislado diversos alcaloides antibióticos de varias especies de Streptomyces, tales como:
Familia Micromonosporaceae:
Familia Nocardiaceae:
Familia Actinoplanaceae:
|  Yatakemycina  Mitomicina A  Duocarmicina A  Estaurosporina  Olivoretina E |
Alcaloides aislados de algas y protozoarios
Phylum Dinoflagellata | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Dinophyceae | Suessiales | Familia Symbiodiniaceae
|  Simbioimina |
Phylum Rhodophyta | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Florideophyceae | Ceramiales | Familia Rhodomelaceae:
Familia Delesseriaceae:
|  Almalozona |
Rhodophyceae | Ceramiales | Familia Delesseriaceae:
Familia Rhodomelaceae:
|  Lofocladina A |
Phylum Chlorophyta | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Bryopsidophyceae | Bryopsidales | Familia Caulerpaceae:
|  Ácido caulerpínico (caulerpina) |
Ulvophyceae | Cladophorales | Familia Cladophoraceae:
| |
Alcaloides aislados de hongos
Phylum Mycetozoa | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Myxogastria | Trichiida | Familia Arcyriaceae:
| 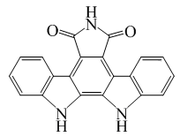 Arciriaflavina A |
Liceida | Familia Reticulariaceae:
| ||
Physarales | Familia Physaraceae:
Family Didymiaceae:
| ||
Phylum Ascomycota | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Saccharomycetes | Saccharomycetales | Familia Saccharomycetaceae:
| |
Incerta sedis | Incerta sedis | Familia Pseudeurotiaceae:
| |
Dothideomycetes | Pleosporales | Familia Pleosporaceae:
Familia Corynesporascaceae
Familia Incerta sedis
| |
Sordariomycetes | Hypocreales | Familia Clavicipitaceae:
Familia Ophiocordycipitaceae:
Familia Hypocreaceae
|  Lolitrem B  Lolina |
Sordariales | Familia Chaetomiaceae:
|  Quetoglobosina A | |
Xylariales | Familia Xylariaceae:
|  Citocalasina A | |
Magnaporthales | Familia Magnaportaceae:
| ||
Eurotiomycetes | Chaetothyriales | Familia Herpotrichiellaceae:
| |
Eurotiales | Familia Trichocomaceae:
Familia Nectriaceae:
Familia Elaphomycetaceae:
|  Ácido aspergílico  Gliotoxina  Talarotoxina | |
Onygenales | Familia Onygenaceae:
Familia Gymnoascaceae:
| ||
Arthoniomycetes | Arthoniales | Familia Roccellaceae:
|  α-Aminoorceína |
Phylum Basidiomycota | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Agaricomycetes | Cantharellales | Familia Ceratobasidiaceae:
|  Eslaframina |
Phallales | Familia Phallaceae:
| ||
Russulales | Familia Russulaceae:
Family Hericiaceae:
|  Necatorina | |
Agaricales | Familia Cortinariaceae:
Familia Tricholomataceae:
Familia Agaricaceae:
Familia Hymenogasteraceae:
Familia Amanitaceae:
Familia Hygrophoraceae:
|  Infractopicrina  Muscimol (Panterina)  Psilocibina | |
Boletales | Familia Boletaceae:
Familia Suillaceae:
Familia Mycenaceae:
|  Sanguinona A  Hematopodina  Paquidermina | |
Polyporales | Familia Meripilaceae:
Familia Fomitopsidaceae:
Familia Polyporaceae:
|  Ácido cinabarínico | |
Thelephorales | Familia Bankeraceae:
| ||
Alcaloides aislados de plantas
Los alcaloides están ampliamente distribuidos en el reino vegetal (25% de las plantas contienen alcaloides) y en algunas especies su concentración puede alcanzar el 10% (flores). En las familias Amaryllidaceae, Fabaceae, Liliaceae, Papaveraceae y Rutaceae los alcaloides tienen gran valor quimiotaxonómico. La familia solanaceae es rica en alcaloides, pero con diferencias a nivel de género. Así, en el tabaco (Nicotiana) hay derivados de la piridina (Nicotina), en Solanum (Patata, berenjena, tomate) se encuentran pseudoalcaloides espirosolánicos (Tomatina) y Datura, Hyoscyamus, Atropa y Scopolia contienen derivados del tropano: hiosciamina, atropina, etc.
Las pirrolizidinas se encuentran principalmente en las familias Compositae, Boraginaceae, Leguminosae y Apocynaceae. Los géneros productores de estos alcaloides están distribuidos en diferentes regiones y climas y podrían representar hasta el 3% de las plantas con flores. Algunas contienen una sola clase de pirrolizidina pero la mayoría contienen entre cinco y ocho clases. El contenido varía con cada especie, pero puede llegar a ser un porcentaje importante del peso seco. La mayor concentración se encuentra en las raíces y es mayor en hojas jóvenes, inflorescencias y capullos que en hojas más viejas. En algunas especies se encontraron altas concentraciones en semillas, lo que implica un riesgo en los casos en que estas semillas se utilicen para la alimentación humana. Existen N-óxidos de estos alcaloides, que son más solubles en agua y se transportan más fácilmente dentro de la planta.
Phylum Pteridophyta | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Pteridopsida | Polypodiales | Familia Davalliaceae:
|  Davaliósidos |
Phyllum Lycopodiophyta | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Lycopodiopsida | Lycopodiales | Familia Lycopodiaceae::
Familia Huperziaceae:
| 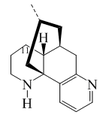 Licodina |
Phyllum Pinophyta | |||
| Clase | Orden | Familias | Ejemplo |
|---|---|---|---|
Pinopsida | Pinales | Familia Pinaceae:
Familia Cephalotaxaceae:
|  Harringtonina. |
Phyllum Gnetophyta | |||
| Clase | Orden | Familias | Ejemplo |
|---|---|---|---|
Gnetopsida | Ephedrales | Familia Ephedraceae:
|  Efedrina. |
Plantas angiospermas:
- Monocotyledonae (Liliopsida;Cronquist): Muchos alcaloides provenientes de monocotiledóneas tienen origen en la fenilalanina y son exclusivos de este grupo taxonómico, tales como los alcaloides fenetilisoquinolínicos y los derivados de la norbeladina.
Phyllum Magnolophyta: Clado Monocots (Clase Liliopsida; Cronquist) | ||
| Orden | Familias | Ejemplos |
|---|---|---|
Liliales | Familia Liliaceae:
Familia Colchicaceae:
Familia Melanthiaceae:
| 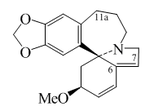 Schelhameridina  Jervina |
Asparagales | Familia Amaryllidaceae:
Familia Asparagaceae:
Familia Xanthorrhoeaceae:
| 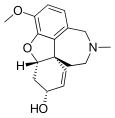 Galantamina |
Arecales | Familia Arecaceae:
| 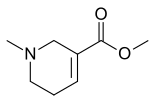 Arecolina |
Poales | Familia Poaceae:
|  Telepogina |
Pandanales | Familia Stemonaceae:
|  Tuberoestemonina |
Orchidales | Familia Orchidaceae:
|  trans-Dendrocrisanina |
Alismatales | Familia Zosteraceae:
Familia Araceae:
|  Irniina |
Dioscoreales | Familia Dioscoreaceae:
|  Dioscorina |
Phyllum Magnolophyta: Clado Eudicots (Clase Magnolopsida; Cronquist) | |||
| Subclase (Cronquist) | Orden | Familias | Ejemplos |
|---|---|---|---|
Magnoliidae | Nymphaeales | Familia Nymphaeaceae:
| |
Piperales | Familia Piperaceae:
Familia Saururaceae:
|  Piperina | |
Aristolochiales | Familia Aristolochiaceae:
|  Ácido aristolóquico | |
Laurales | Familia Calycanthaceae:
Familia Hernandiaceae:
Familia Atherospermataceae
|  Vanuatina | |
Magnoliales | Familia Magnoliaceae:
Familia Annonaceae:
Familia Himantandraceae:
Familia Myristicaceae:
|  Eupolauridina  Espiguetidina  Oniquina | |
| Ranunculidae (Cronquist) | Ranunculales | Familia Ranunculaceae:
Familia Berberidaceae:
Familia Menispermaceae:
|  Aconitina  Berberina  Menisporfina  Rufescina |
Papaverales | Familia Papaveraceae (incluye ant. fam. Fumariaceae):
| 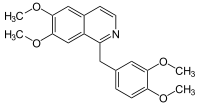 Papaverina 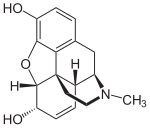 Morfina 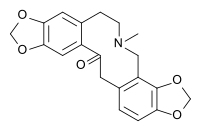 Protopina | |
Caryophyllidae (Cronquist): Todas producen betalaínas en lugar de antocianinas. | Caryophyllales | Familia Cactaceae:
Familia Ancistrocladaceae:
Familia Amaranthaceae:
Familia Polygonaceae:
|  Anhalamina |
Dileniidae (Cronquist) | Cucurbitales | Familia Cucurbitaceae:
|  L-β-Pirazol-1-ilalanina |
Ericales | Familia Theaceae:
Familia Lecythidaceae:
Familia Actinidiaceae
|  | |
Brassicales | Familia Caricaceae
Familia Capparaceae:
Familia Brassicaceae:
Familia Salvadoraceae:
| 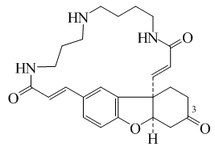 Lunarina  Ascorbígeno | |
Malvales | Familia Malvaceae:
| ||
Hamamelidae | Daphniphyllales | Familia Daphniphyllaceae:
|  |
Fagales | Familia Fagaceae:
Familia Casuarinaceae:
| ||
Rosidae (Cronquist) | Malpighiales | Familia Phyllanthaceae:
Familia Salicaceae:
Familia Rhizophoraceae:
|  Securinina  Astrofilina  Gerrardina |
Celastrales | Familia Celastraceae
|  Macrolactonas del ácido evonínico | |
Fabales | Familia Fabaceae:
|  Ormosamina  Angustifolina  Latirina 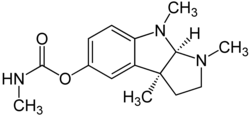 Fisostigmina 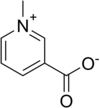 Trigonelina  Gramodendrina | |
Proteales | Familia Elaeagnaceae:
Familia Nelumbonaceae:
Familia Proteaceae
|  Neferina  Chalcostrobamina | |
Rosales | Familia Moraceae:
Familia Urticaceae:
Familia Crassulaceae
| 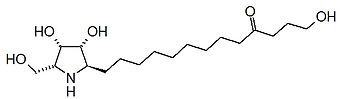 Broussonetinina A  Criptopleurina  Sedacriptina | |
Cornales | Familia Nyssaceae:
Familia Hydrangeaceae:
Familia Alangiaceae:
|  Camptotecina | |
Zygophyllales | Familia Zygophyllaceae:
|  Harmina | |
Oxalidales | Familia Elaeocarpaceae:
|  Aristotelina  Eleocarpina | |
Sapindales | Familia Rutaceae:
Familia Meliaceae:
Familia Simaroubaceae:
Familia Nitrariaceae:
|  Pilocarpina  Cusparina  Dictamnina  Rutacridona  Rohitukina | |
Euphorbiales | Familia Buxaceae:
Familia Euphorbiaceae:
|  Astrocasina  Julocrotina | |
Myrtales | Familia Lythraceae:
Familia Combretaceae:
Familia Vochysiaceae
|  Soneratina A | |
Apiales | Familia Apiaceae:
Familia Vochysiaceae:
|  Coniina | |
Asteridae (Cronquist): | Solanales | Familia Convolvulaceae:
Familia Solanaceae:
|  Cocaína  α-Solanina  Nicotina  Anaferina |
Asterales | Familia Asteraceae:
Familia Campanulaceae:
|  Lobelina  Cotuzinas | |
Lamiales | Familia Boraginaceae:
Familia Acanthaceae:
Familia Bignoniaceae:
Familia lamiaceae:
| 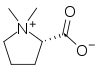 Estaquidrina | |
Gentianales | Familia Loganiaceae:
Familia Gentianaceae:
Familia Apocynaceae: Esta familia representa uno de los grupos más importantes en lo que a diversidad de alcaloides concierne:
Familia Rubiaceae:
Familia Gelsemiaceae:
| 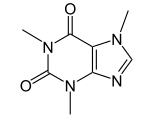 Cafeína  Reserpina  Ibogaína  Elipticina  Conofilidina  Vinblastina | |
Alcaloides aislados de animales
Phylum Porifera | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Demospongiae | Hadromerida | Familia Suberitidae:
Familia Trachycladidae
|  Aaptamina |
Haplosclerida | Familia Petrosiidae:
Familia Callyspongiidae:
Familia Chalinidae:
Familia Niphatidae:
Familia Chalinidae
| 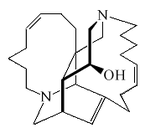 Ingenamina  Xestospongina A 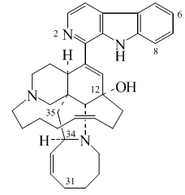 Manzamina A | |
Poecilosclerida | Familia Myxillidae:
Familia Acarnidae:
Familia Hymedesmiidae
|  Dilemaona A | |
Astrophorida | Familia Ancorinidae:
Familia Coppatidae
|  Ancorinósido A | |
Agelasida | Familia Agelasidae:
Familia Astroscleridae:
|  Palauamina | |
Halichondrida | Familia Axinellidae:
Familia Halichondriidae:
| ||
Dictyoceratida | Familia Thorectidae:
Familia Irciniidae:
Familia Spongiidae
| ||
Poecilosclerida | Familia Chondropsidae:
Familia Crambeidae:
| ||
Choristida | Familia Ancorinidae:
| ||
Dendroceratida | Familia Darwinellidae:
| ||
Lithistida | Familia Theonellidae:
| 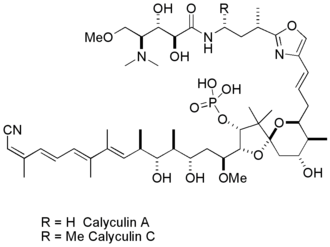 | |
Verongida | Familia Pseudoceratinidae:
| ||
Calcarea | Clathrinida | Familia Clathrinidae (Naamidinas, poliandrocarpaminas, leucetamina; Leucetta ) | |
Phylum Cnidaria | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
| Anthozoa | Alcyonacea | Familia Xeniidae:
|  Cespitulactama D |
Pennatulacea | Familia Renillidae:
|  Coelenteracina | |
Actiniaria | Familia Stichodactylidae
| ||
Scleractinia | Familia Dendrophylliidae:
Familia Acroporidae
| ||
Antipatharia | Familia Antipathidae
| ||
Zoanthidea | Familia Parazoanthidae
| ||
Stolonifera | Familia Clavulariidae
| ||
Phylum Bryozoa | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Gymnolaemata | Cheilostomata | Familia Flustridae:
|  Chartelina A |
Ctenostomata | Familia Vesiculariidae
| ||
Phylum Platyhelminthes | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Turbellaria | Polycladida | Familia Euryleptidae:
|  Villatamina A |
Phylum Mollusca | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Bivalvia | Mytiloida | Familia Mytilidae
| 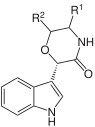 Estructure general de las oxazininas |
Pterioida | Familia Pinnidae
|  Ácido pinnaico | |
Gastropoda | Opisthobranchia | Familia Gymnodorididae:
Familia Velutinidae:
Familia Aglajidae
| |
Sorbeoconcha | Familia Muricidae:
Familia Babyloniidae:
|  Surugatoxina | |
Vetigastropoda | Familia Trochidae
| ||
Anaspide | Familia Aplysiidae
| ||
Nudibranchia | Familia Discodorididae
Familia Proctonotidae
|  Janolusimida | |
Phylum Arthropoda | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Insecta | Diptera | Familia Drosophilidae:
Familia Tephritidae
| |
Coleoptera | Familia Coccinellidae:
Familia Staphylinidae: Alcaloides pirrolidínicos (Estenusinas; Stenus) |  Estenusina  Hipodamina | |
Himenoptera | Familia Crabronidae:
Familia Formicidae:
Familia Vespidae:
| ||
Lepidoptera | Familia Pieridae:
Familia Gelechiidae:
Familia Arctiidae
Familia Nymphalidae
Familia Saturniidae
| ||
Diplopoda | Glomerida | Familia Glomeridae:
|  Glomerina |
Polyzoniida | Familia Polyzonidae:
|  Nitropolizonamina | |
Phylum Echinodermata | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Crinoidea | Comatulida | Familia Himerometridae
|  Homoaerotionina |
Stelleroidea | Ophiurida | Familia Ophiocomidae
|  Ofiuroidina |
Phylum Chordata | |||
| Clase | Orden | Familias | Ejemplos |
|---|---|---|---|
Ascidiacea | Enterogona | Familia Polyclinidae:
Familia Clavelinidae:
Familia Perophoridae:
Familia Pseudodistomidae:
|  Haouaminas  Ascidiatiazona B |
Phlebobranchia | Familia Diazonidae
|  Diazonamida A | |
Aplousobranchia | Familia Didemnidae:
Familia Polycitoridae
|  Ascididemina  Riterazina M | |
Stolidobranchia | Familia Styelidae:
|  Policarpina | |
Amphibia | Caudata | Familia Salamandridae:
|  Samandarina |
Anura | Familia Dendrobatidae:
|  Histrionicotoxina 283A | |
Aves | Cuculiformes | Familia Musophagidae:
|  Turacina |
Passeriformes | Familia Pachycephalidae:
|  Batraciotoxina | |
Mammalia | Carnivora | Familia Mustelidae:
Familia Mephitidae:
Familia Canidae
|  2-(Mercaptometil)quinolina |
Véase también
- Pseudoalcaloide
Referencias
↑ Robinson T. 1981. The biochemistry of alkaloids. 2ª ed. Springer, Nueva York.
↑ Azcón-Bieto,J y Talón, M. (2000). Fundamentos de Fisiología Vegetal. Mc Graw Hill Interamericana de España SAU. ISBN 84-486-0258-7.
↑ Fattorusso E., Tagliatela-Scafati O. Modern alkaloids. Structure, isolation, synthesis and biology. (2008) Wiley-VCH.
↑ «{title}». Archivado desde el original el 12 de enero de 2008. Consultado el 11 de septiembre de 2010.
↑ K. Gerth, H. Irschik, H. Reichenbach, W. Trowitzsch, J. Antibiot. (1980) 33:1474
↑ Polar alkaloids from the Caribbean marine sponge Niphates digitalis. Regalado EL, Mendiola J, Laguna A, Nogueiras C, Thomas OP. Nat Prod Commun. (2010) v.5(8):pp.1187-1190.
↑ Biosynthesis of the chromogen hermidin from Mercurialis annua L. Elena Ostrozhenkova, Eva Eylert, Nicholas Schramek, Avi Golan-Goldhirsh, Adelbert Bacher a,c, Wolfgang Eisenreic. Phytochemistry v.68 (2007):pp. 2816–2824
↑ Hachijodines A-G: Seven New Cytotoxic 3-Alkylpyridine Alkaloids from Two Marine Sponges of the Genera Xestospongia and Amphimedon. Sachiko Tsukamoto, Motohiko Takahashi, Shigeki Matsunaga, Nobuhiro Fusetani, Rob W. M. van Soest J. Nat. Prod. (2000) v.63:pp. 682-684
↑ Walsh, C. T., Garneau-Tsodikova, S. & Howard-Jones, A. R. Biological formation of pyrroles: Nature’s logic and enzymatic machinery. Nat. Prod. Rep. 23, 517–531 (2006).
↑ Structure, Chemical Synthesis, and Biosynthesis of Prodiginine Natural Products Dennis X. Hu, David M. Withall, Gregory L. Challis, and Regan J. Thomson Chemical Reviews Article ASAP
doi 10.1021/acs.chemrev.6b00024
↑ Yang et al. "Two new alkaloids from the Dendrobium chrysanthum". Heterocycles 65(3):633-636
↑ Indolizidine Alkaloids. Gellert, E.J. Nat. Prod. (1982) v.45:p.50.
↑ The Biosynthesis Of Lunarine In Seeds Of Lunaria Annua Silvia Sagner, Zheng-Wu Shen, Brigitte Deus-Neumann And Meinhart H. Zenk. Phytochemistry (1998) V. 47(3): pp. 375-387,
↑ Motuporamines, Anti-Invasion and Anti-Angiogenic Alkaloids from the Marine Sponge Xestospongia exigua (Kirkpatrick): Isolation, Structure Elucidation, Analogue Synthesis, and Conformational Analysis. David E. Williams, Kyle S. Craig, Brian Patrick, Lianne M. McHardy, Rob van Soest, Michel Roberge, and Raymond J. Andersen. J. Org. Chem. (2002) v.67:p.245-258
↑ Characterisation of the paralytic shellfish toxin biosynthesis gene clusters in Anabaena circinalis AWQC131C and Aphanizomenon sp. NH-5 Troco K Mihali1, Ralf Kellmann and Brett A Neilan. BMC Biochemistry (2009) v.10:p.8
↑ Barbier. Journal of Chemical Ecology, Vol. 16, No. 3, 1990
↑ Gupta, R.N.; Horsewood P., Koo S.H., Spenser I.D. Can. J. Chem (1979) v.57:pp.1606-1614
↑ M. J. Wanner and G.-J. Koomen Studies in Natural Products Chemistry: Stereoselectivity in Synthesis and Biosynthesis of Lupine and Nitraria Alkaloids ed. Atta-ur-Rahman; Elsevier: Amsterdam,1994, vol. 14, pp. 731–768.
↑ Gravel E. Poupon E. Biosynthesis and biomimetic synthesis of alkaloids isolated from plants of the Nitraria and Myrioneuron genera: an unusual lysine-based metabolism. Nat. Prod. Rep. (2010) 27:32–56
↑ Katsuhiro. Konno, Kimiko. Hashimoto, Yasufumi. Ohfune, Haruhisa. Shirahama, and Takeshi. Matsumoto. Acromelic acids A and B. Potent neuroexcitatory amino acids isolated from Clitocybe acromelalga. J. Am. Chem. Soc. 110, 14, 4807-4815.
↑ Sankawa, U. et al. Phytochemistry (1977) v.16: pp.561- 563
↑ Guinaudeau, H. and Shamma, M. J. Nat. Prod. (1982) v.45:237
↑ Montgomery, C.T. et al. J. Nat. Prod. (1983) v.46:441.
↑ Krane, B.D. et al. J. Nat. Prod. (1984) 47, 1.
↑ Blasko, G. et al. J. Nat. Prod. (1982) v.45:p.105.
↑ Andersen, R.J. et al., JACS, 1985, 107, 5492- 5495
↑ Wiegrebe, W. et al. J. Nat. Prod. (1984) v.47:p.397.
↑ Ghosal, S. et al. (1985) Phytochemistry, 24, 2141.
↑ Ahmad, V.U. et al., Tetrahedron, 1987, 43, 5865
↑ Ahmad, V.U. et al., Phytochemistry, 1991, 30, 1350- 1351
↑ Ahmad, V.U. et al., J. Nat. Prod., 1992, 55, 237
↑ Clement JS, TJ Mabry, H Wyler y AS Dreiding. 1994. "Chemical review and evolutionary significance of the betalains". En: Caryophyllales, H-D Behnke y TJ Mabry (eds.) 247-261. Springler, Berlin.
↑ Strack D., Vogt T., Schliemann W. "Recent advances in betalain research." Phytochemistry (2003) V.62:247–269.
↑ «Phenazine-1-carboxylic acid, a secondary metabolite of Pseudomonas aeruginosa, alters expression of immunomodulatory proteins by human airway epithelial cells». American Journal of Physiology 285: 584-L592. 2003. doi:10.1152/ajplung.00086.2003.
↑ Levy, L. M.; Cabrera, G. M.; Wright, J. E.; Seldes A. M. Phytochemistry (2000) 54, 941
↑ Pigments of Higher Fungi: A Review. Jan Velísek and Karel Cejpek Czech J. Food Sci. (2011) 29(2): 87–102
↑ Overman, L.E. and Sworin, M. (1985) in Alkaloids: Chemical and Biological Perspectives, (ed. S.W. Pelletier), Vol. 3, Wiley-Interscience, New York.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Alcaloide.
Wikimedia Commons alberga una galería multimedia sobre Alcaloide.
 Wikcionario tiene definiciones y otra información sobre alcaloide.
Wikcionario tiene definiciones y otra información sobre alcaloide.
Lista de alcaloides importantes en qbitácora (blog).


