Organisme génétiquement modifié
Un organisme génétiquement modifié (OGM) est un organisme vivant dont le patrimoine génétique a été modifié par l'intervention humaine. Selon les définitions européennes, ces modifications doivent être issues du génie génétique[1],[2],[3]. La définition américaine inclut également les modifications issues de la sélection artificielle[4],[5]. Le génie génétique permet de modifier des organismes par transgénèse, c’est-à-dire l'insertion dans le génome d’un ou de plusieurs nouveaux gènes. Un « organisme transgénique », terme qui désigne les organismes qui contiennent dans leur génome des gènes « étrangers », est donc toujours un organisme génétiquement modifié, l'inverse n'étant pas toujours vrai.
La mise en œuvre de transgénèses permet un transfert de gènes héritables[6] entre espèces évolutivement plus ou moins séparées (par exemple un gène prélevé sur le ver luisant et transféré chez le taureau[7]) mais aussi de transférer des gènes entre espèces proches quand les techniques de croisement classique ont échoué (pomme de terre Fortuna). L'aspect novateur de ces nouvelles techniques ainsi que leurs applications potentielles, notamment dans les secteurs médical et agricole, ont provoqué une controverse, une réflexion éthique[8] ainsi qu'une guerre commerciale et des réglementations. Au sein des biotechnologies, les OGM sont un domaine de recherche qui fait depuis les années 1990 l'objet de nombreux investissements en recherche et développement à partir de financements tant publics que privés.
Inexistantes avant 1993, les surfaces cultivées OGM, représentent en 2011, selon l'ISAAA, une association non-gouvernementale de promotion des biotechnologies, 160 millions d’hectares[9], dont près de 50 % dans les pays en développement[9]. Cela représente 3 % des terres agricoles à l'échelle mondiale, bien que pour certains pays, comme les États-Unis, elles représentent 17 % des surfaces agricoles et 47 % des surfaces arables[9]. Selon le même organisme, le marché du produit final des cultures commerciales de maïs, de soja et de coton est évalué à plus de 160 milliards de dollars en 2011, et à 13,2 milliards de dollars pour celui des semences[9]. Des organisations écologistes estiment cependant que les chiffres concernant les surfaces cultivées sont surévalués[10].
En mai 2010, le journal Science rapporte la réalisation du premier organisme dont l'intégralité du génome a été synthétisée par des scientifiques. Il ne s'agit pas d'une « création » en tant que telle mais de la fabrication artificielle d'un génome préexistant[11],[12].
Plusieurs méta-analyses, portant sur des milliers d'études et plusieurs décennies d'observations, permettent d'établir que les OGM ne sont pas nocifs[13]. Ce consensus scientifique, établi depuis au moins 2012, est confirmé par de nombreuses organisations scientifiques internationales, et notamment le Conseil international pour la science, qui affirment également que les OGM commercialisés ne sont pas dangereux pour la santé humaine, et que les risques de dissémination sont correctement contrôlés. Des associations, comme le Comité de recherche et d'information indépendantes sur le génie génétique (CRIIGEN) financé par des acteurs du bio, en France, ou le Independant Science Panel[14], au Royaume-Uni, estiment que les études auxquelles les organismes d'accréditation font référence sont insuffisantes, et que dans le domaine des cultures en plein champ les précautions prises ne permettent pas d'éviter la pollution génétique de l'environnement. Elles sont relayées en ce sens par les partisans du mouvement anti-OGM.
En 2016, 107 Prix Nobel signent une pétition demandant à Greenpeace d'arrêter sa campagne anti-OGM ciblant notamment le riz doré, précisant que les OGM sont aussi sains que les autres productions agricoles et qu'aucun effet négatif de leur part n'a jamais été constaté, ni sur la santé, ni sur l'agriculture, et permettent de combattre la mortalité infantile due à la malnutrition[15]. Cette pétition a par la suite été critiquée, notamment parce que le riz doré en question n'est pas encore au point (il ne permet donc pas de combattre la malnutrition). D'après l'anthropologue Glen Stone « il s'agit d'une manipulation de l'opinion publique par l'utilisation de scientifiques qui ne sont pas informés des faits sur le sujet »[16].
Sommaire
1 Définition
1.1 Différents OGM
1.2 Comparaison avec les autres échanges de gènes
1.2.1 Échanges de gènes sans intervention humaine
1.2.2 Échanges de gènes réalisés par l’homme avant les OGM
1.2.2.1 Sélection
1.2.2.2 Hybridation
2 Histoire
2.1 De la génétique au génie génétique
2.2 Premiers pas
2.3 Évolution du droit
2.4 Commercialisation progressive
3 Organismes transgéniques
3.1 Différentes étapes d'élaboration
3.2 Procaryotes, bactéries et archéobactéries
3.3 Eucaryotes (plantes, animaux, champignons)
3.3.1 Vecteur génétique
3.3.2 Transfert du matériel génétique dans l'organisme cible
3.3.2.1 Transfert indirect d'ADN ou transfert biologique
3.3.2.2 Transfert direct d'ADN
3.3.2.3 Croisement et fusion cellulaire
3.3.3 Intégration du matériel génétique dans le génome de l'organisme modifié
4 Gènes utilisés
4.1 Gènes marqueurs
4.2 Gènes de résistances
4.3 Gène de stérilité
4.4 Gènes antisens ou sens bloquant la traduction d'autres gènes
4.5 Gènes rapporteurs
4.6 Production de protéines
5 Principales applications
5.1 Recherche fondamentale
5.1.1 Gènes du développement et évolution
5.1.2 Cartographie et séquençage des génomes
5.1.3 Localisation cellulaire du produit d'un gène
5.2 Domaine médical
5.2.1 Domaine existant
5.2.2 Recherche en cours
5.2.2.1 Moléculture
5.2.2.2 Xénogreffe
5.2.2.3 Thérapie génique
5.3 Végétaux génétiquement modifiés et utilisés dans l'agroalimentaire
5.3.1 Domaine existant
5.3.2 Recherches en cours
5.4 Animaux génétiquement modifiés et utilisés dans l'agroalimentaire
5.4.1 Recherches en cours
5.5 Utilisation pour l'industrie
5.5.1 Domaine existant
5.5.1.1 Amflora
5.5.2 Recherche en cours
6 Réglementation et utilisation des OGM à travers le monde
6.1 Sécurités sanitaires européennes
6.2 Procédure d'autorisation
6.2.1 Marché d'OGM en tant que produits
6.2.2 Dissémination expérimentale dans l'environnement
6.3 Surfaces cultivées
7 Débats
7.1 Risques sanitaires
7.2 Opposition
7.3 Risques environnementaux
7.4 Arguments favorables
7.5 Éthique
7.6 Économie
7.7 Recherche et conflits d'intérêts
8 Notes et références
8.1 Notes
8.2 Références
9 Annexes
9.1 Bibliographie
9.1.1 Ouvrages de références
9.1.2 Essais
9.2 Article connexe
9.2.1 Organisations non gouvernementales
9.3 Liens externes
9.3.1 Sites d'organisations gouvernementales
9.3.1.1 Canada
9.3.1.2 France
9.3.1.3 Suisse
9.3.1.4 International
9.3.2 Dossiers à vocation scientifique
Définition |
Dans toute l'acception du terme, un « organisme génétiquement modifié » est un organisme vivant (micro-organisme, végétal ou animal) dont le génome a été modifié artificiellement. Cette acception inclut toutes les voies possibles de modification de l'information génétique, allant de la méthode des croisements aux outils du génie génétique[17].
D'un point de vue législatif, un grand nombre de pays et d'organisations utilisent une définition plus restrictive en référence à celle précisée lors du Protocole de Carthagène sur la prévention des risques biotechnologiques et qui entend par « Organisme vivant modifié » « tout organisme vivant possédant une combinaison de matériel génétique inédite obtenue par recours à la biotechnologie moderne »[18]. Cependant, cette définition n'est pas reconnue universellement[19]. Certains pays, dont les États-Unis, ne font pas de ce recours à la biotechnologie moderne une notion discriminante. Ainsi, si l’Union européenne, dans la directive 2001/18/CE définit un OGM comme « un organisme, à l'exception des êtres humains, dont le matériel génétique a été modifié d'une manière qui ne s'effectue pas naturellement par multiplication et/ou par recombinaison naturelle »[20] et si l’OCDE définit les OGM comme : « a plant or animal micro-organism or virus, which has been genetically engineered or modified »[21], les États-Unis considèrent qu'un OGM est un organisme ayant subi un « changement dans le matériel génétique [...], que ce soit par l'intermédiaire de la sélection classique, du génie génétique [ou] de la mutagenèse »[22]. Certains pays, comme le Canada, même s'ils acceptent la définition « restrictive », appliquent aux « OGM » la même règlementation que celle qui a cours pour les produits modifiés par des méthodes classiques[23].
Les controverses qui s'expriment à l'égard des « OGM » portent essentiellement sur ceux qui relèvent de la définition « restrictive », soit ceux obtenus par génie génétique.
La transgénèse est l'opération de génie génétique la plus couramment utilisée pour l'obtention d'« OGM ». Ainsi, organisme transgénique, est souvent utilisé comme synonyme d'organisme génétiquement modifié. Cependant, si un « organisme transgénique » est toujours un « organisme génétiquement modifié », un « organisme génétiquement modifié » n'est pas toujours un « organisme transgénique ».
L'intervention humaine conduisant à fabriquer des OGM consiste dans la majorité des cas à ajouter une petite portion d'ADN d'un organisme dans l'ADN d'un autre organisme (transgénèse). Les techniques sont[24] :
- techniques de recombinaison de l'ADN impliquant la formation de nouvelles combinaisons de matériel génétique par l'insertion de molécules d'acide nucléique, produites de n'importe quelle façon hors d'un organisme, à l'intérieur de tout virus, plasmide bactérien ou autre système vecteur et leur incorporation dans un organisme hôte à l'intérieur duquel elles n'apparaissent pas de façon naturelle, mais où elles peuvent se multiplier de façon continue ;
- techniques impliquant l'incorporation directe dans un organisme de matériel héréditaire préparé à l'extérieur de l'organisme, y compris la micro-injection, la macro-injection et le microencapsulation ;
- techniques de fusion cellulaire (y compris la fusion de protoplastes) ou d'hybridation dans lesquelles des cellules vivantes présentant de nouvelles combinaisons de matériel génétique héréditaire sont constituées par la fusion de deux cellules ou davantage au moyen de méthodes qui ne sont pas mises en œuvre de façon naturelle.
Selon la directive adoptée par l’Union européenne, les techniques de modifications génétiques à exclure de son champ d'application sont[24] :
- la mutagenèse technique ancienne très utilisée à partir des années 1950 ;
- la fusion cellulaire (y compris la fusion de protoplastes) de cellules végétales d'organismes qui peuvent échanger du matériel génétique par des méthodes de sélection traditionnelles ;
- la fécondation in vitro ;
- les processus naturels tels que la conjugaison, la transduction, la transformation, ou l'induction polyploïde. (sauf emploi d'acide nucléique recombinant ou d'OGM déjà obtenu).
| Pays | Définitions |
|---|---|
Institut national de la recherche agronomique (INRA)[1] | « OGM (Organisme génétiquement modifié) Organisme dont le génome a été modifié par génie génétique. Les cellules reproductrices de l'organisme possèdent la modification qui est donc transmissible à la descendance. » |
Site interministériel sur les OGM[2] | « Un organisme génétiquement modifié (OGM) est un organisme (animal, végétal, bactérie) dont on a modifié le matériel génétique (ensemble de gènes) par une technique nouvelle dite de "génie génétique" pour lui conférer une caractéristique nouvelle. » |
OCDE[25] | « Plant or animal micro-organism or virus, which has been genetically engineered or modified » |
FDA Administration chargée de contrôler les aliments et les médicaments | La FDA utilise le terme genetically engineered food pour la nourriture qualifiée de OGM par la Commission européenne[4]: « Un aliment issu du génie génétique est produit à partir de semence dont la composition génétique a été changée par une technique appelée ADN recombinant, ou gene splicing, pour apporter à la plante un caractère souhaité. Des aliments issus du génie génétique sont aussi dits génétiquement modifiés, bien que « génétiquement modifiés » puisse s'appliquer aussi aux aliments issus de plantes modifiées par d'autres méthodes de culture (croisement NDT)»[26] |
Département de l'Agriculture USDA[5] | « Modification génétique: production d'amélioration héréditaire chez des plantes ou des animaux dans un but spécifique aussi bien par les techniques du génie génétique que par les méthodes plus traditionnelles d'amélioration. Certains autres pays que les États-Unis utilisent ce terme uniquement pour ce qui est obtenu par génie génétique. OGM: organisme produit par des modifications génétiques. » |
Agence canadienne d’inspection des aliments[27] | « Modification génétique (MG) : Tout changement dans le matériel génétique d'un organisme, que ce soit par l'intermédiaire de la sélection classique, du génie génétique, de la mutagenèse, etc. Un OGM est un organisme génétiquement modifié. Pour certains, cependant, l'utilisation du terme OGM est plus restreinte et ne concerne que les organismes modifiés au moyen de techniques de génie génétique. Sélection classique : Méthode utilisée pour sélectionner certains caractères chez les descendants de plantes ou d'animaux (aussi appelée reproduction sélective). Le recours au croisement sélectif permet de produire différentes variétés de plantes et races d'animaux. |
Directive 2001/18/CE du Parlement européen et du Conseil du 12 mars 2001[3] | « "Organisme génétiquement modifié (OGM)" : un organisme, à l'exception des êtres humains, dont le matériel génétique a été modifié d'une manière qui ne s'effectue pas naturellement par multiplication et/ou par recombinaison naturelle. Les techniques de modification génétique [...] sont, entre autres :
|
Loi sur le génie génétique[28] | « Par organisme génétiquement modifié, on entend tout organisme dont le matériel génétique a subi une modification qui ne se produit pas naturellement, ni par multiplication ni par recombinaison naturelle » |
| Encarta francophone[29] | « Organismes vivants (bactéries, plantes ou animaux) dont le matériel génétique (génome) a été artificiellement modifié, le plus souvent pour contenir un nouveau gène. Les OGM peuvent donc être aussi bien des virus, des unicellulaires (bactéries et protistes), que des plantes ou des animaux ; ils comportent obligatoirement des séquences d’ADN issues de manipulations in vitro, ce qui exclut donc toutes les modifications dues à des mutations ou des recombinaisons génétiques naturelles. Les techniques utilisées pour modifier le matériel génétique des organismes vivants sont réunies sous le nom de transgénèse : le nouveau gène est qualifié de transgène, et les OGM portent également le nom d’organismes transgéniques. » |
| Encarta anglophone[30] | MGO: « Genetically Modified Organism » Pas de définition. |
| Les organismes génétiquement modifiés (OGM) sont des organismes dont le patrimoine génétique (l’ADN) a été transformé d’une manière qui ne survient pas spontanément dans la nature. Cette technologie moderne a plusieurs appellations courantes « biotechnologie moderne », « technologie génique », parfois aussi « technique de l’ADN recombinant » ou « génie génétique ». Elle permet de sélectionner des gènes à transférer d’un organisme à l’autre, même si ces organismes appartiennent à des espèces non apparentées. » | |
| Un OGM peut être défini « comme un organisme, à l'exception des humains, dans lequel le matériel génétique a été altéré d'une manière qui ne se produit pas naturellement par croisement ou recombinaison naturel. » | |
NERC[33] | « Un organisme génétiquement modifié est un organisme dont on a altéré l'ADN dans un but précis. Ils peuvent être des virus, des bactéries, des plantes ou des animaux. Habituellement une petite section d'ADN d'un organisme est introduite dans un l'ADN d'un autre organisme avec lequel il ne se croise pas normalement. » |
Department for Environment, Food and Rural Affairs[34] | Un OGM est défini dans la législation « comme un organisme, à l'exception des humains, dans lequel le matériel génétique a été altéré d'une manière qui ne se produit pas naturellement par croisement ou recombinaison naturel. » |
Dictionnaire de la cité des sciences[35] | « Organisme auquel on a transféré un ou plusieurs gènes appartenant à une autre espèce, transmissible(s) à ses descendants. Un OGM est un animal, une plante ou un micro-organisme possédant dans son génome un ou plusieurs gènes étrangers issus d’une autre espèce, appelés " transgènes " ou gènes d’intérêt. Les OGM sont obtenus par les techniques de transgenèse. Le but est de faire fabriquer par l’OGM une protéine (codée par le transgène) utile pour la recherche, la médecine (production de médicaments), l’agriculture… » |
| Greenpeace[36] | « Un Organisme Génétiquement Modifié (OGM) est un organisme vivant (micro-organisme, plante, animal) dont on a modifié le patrimoine génétique afin de le doter de propriétés que la nature ne lui a pas attribuées. » |
Semencier Limagrain[37] | « Un “OGM” : C’est un organisme (plante, animal ou micro-organisme) dont le génome a été volontairement modifié par l’Homme, grâce à une technique :la transgenèse, associant culture in vitro et génie génétique. » |
Service international pour l'acquisition d'applications agricoles biotechnologiques (ISAAA)[38] | « Un organisme génétiquement modifié (OGM) est un organisme dans lequel un ou deux (rarement plus) gènes d’un organisme dont l’apparentement est proche ou distant ont été introduits afin de lui conférer une nouvelle caractéristique. Dans le cas de plantes, une plante génétiquement modifiée contient un ou plusieurs gènes qui ont été insérés grâce à la biotechnologie au lieu d’être acquis via la pollinisation et une amélioration sélective des plantes. La séquence du gène inséré (c.-à-d. le transgène) peut provenir de la même espèce ou d’une espèce complètement différente. » |
Différents OGM |
Un grand nombre d'OGM sont créés uniquement dans le but de mener des expériences scientifiques. Pour comprendre le fonctionnement d'un organisme, la modification de son génome est aujourd'hui l'un des outils les plus utilisés[39],[40],[41].
De nombreux micro-organismes (bactéries, microalgues, levures, microchampignons) sont relativement faciles à modifier et à cultiver, et sont un moyen relativement économique pour produire des protéines particulières à visée médicale: insuline, hormone de croissance, etc. Des essais sont également menés dans le même but à partir de mammifères, en visant la production de la protéine recherchée dans le lait, facile à recueillir et traiter[42]. Les protéines ainsi obtenues, dites recombinantes, ne sont pas elles-mêmes des OGM.
Les plantes cultivées principales (soja, maïs, cotonnier, colza, betterave, courge, papaye, tabac, etc.) ont des versions génétiquement modifiées, avec de nouvelles propriétés agricoles : résistance aux insectes, tolérance à un herbicide, enrichissement en composants nutritifs[43]. Cependant, dans le contexte agro-alimentaire, ces nouvelles variétés suscitent des controverses[44].
Les principales plantes GM cultivées en 2006 sont le soja et le maïs qui servent essentiellement à l’alimentation du bétail. Ensuite on trouve aussi du colza et du coton... puis de façon plus anecdotique de la papaye, de la luzerne, des betteraves.
Les animaux transgéniques sont plus difficiles à obtenir[45]. Peu d'animaux transgéniques ont été autorisés. On trouve deux poissons d'aquarium, comme le GloFish, un moustique transgénique male stérile destiné à combattre la dengue et un saumon transgénique génétiquement modifié pour grossir plus vite[46].
Si une lignée d’humains était issue de modifications génétiques, elle ferait partie des OGM[47].
Comparaison avec les autres échanges de gènes |
Échanges de gènes sans intervention humaine |
La dénomination d'organisme génétiquement modifié fait référence à une modification artificielle du patrimoine génétique d'un organisme. Mais des mutations spontanées ainsi que des systèmes de transfert naturel d'ADN appelé transfert horizontal de gènes existent qui conduisent à l'apparition d'organismes dont le matériel génétique est inédit. Ainsi, par exemple, le tabac (Nicotiana tabacum) et le blé résultent de l'addition spontanée de génomes ancestraux[48]. Découvert à la fin des années 1950[49],[50], le transfert horizontal de gènes a depuis été reconnu comme un processus majeur de l'évolution des bactéries, mais aussi des eucaryotes
[51],[52]. L'apparition de nouveaux gènes dans une espèce est un élément important du processus d'évolution des espèces.
Les principaux dispositifs d'échanges naturels de gènes, dont certains sont exploités par les techniques du génie génétique, sont les suivants :
- Les rétrovirus sont des virus capables de faire intégrer leur information génétique dans le génome de leur hôte. Grâce à des séquences présentes de part et d’autre de l’ADN viral, qui sont reconnues par le génome hôte, ce dernier accepte sa césure et l’intégration de l'ADN viral. Les conséquences pour l'hôte sont rarement positives, elles consistent surtout en maladies, cancers, gale, et même rapidement la mort.
- Le plasmide, qui est une petite molécule circulaire d’ADN, est mobile et peut passer d’une cellule à une autre. Certains plasmides peuvent alors s’intégrer au génome de la cellule hôte. Cette forme de transfert d'ADN est observée pour les bactéries, notamment pour des gènes de résistance aux antibiotiques. L’intégration de plasmide bactérien au génome d'un domaine différent (eucaryotes ou archaea) est limité à des bactéries spécifiques, et pour des couples d'espèces déterminés. Ainsi, Agrobacterium tumefaciens est une bactérie dont un fragment de son plasmide (l'ADN-T) est capable d’entrer dans une cellule végétale et de s’intégrer à son génome.
- Dans le cadre de l'endosymbiose, un ensemble de processus évolutifs ont conduit à la formation d'organites (mitochondries et chloroplastes) dans les cellules eucaryotes, à la suite de l'intégration d'alpha-protéobactéries et de cyanobactéries. La majorité du génome des endosymbiotes a été transféré dans le noyau de l'hôte.
On citera également d'autres types d'évènements qui ne participent pas aux échanges de matériel génétiques, mais qui restent importants dans le contexte.
- La reproduction entre individus interféconds permet la diffusion de matériel génétique. Le produit peut être un hybride présentant des caractéristiques génétiques propres. En outre, la reproduction peut être l'occasion pour des virus et autres organismes facteurs d'échange de gènes de passer d'un partenaire à l'autre.
- Les mutations, ne sont pas en elles-mêmes une voie d'échange, mais elles peuvent produire le nouveau matériel génétique qui sera diffusé ensuite par échange, participant ainsi à l'évolution des espèces. Beaucoup de mutations sont neutres, certaines sont favorables, mais d'autres sont associées à des maladies génétiques ou des cancers.
Échanges de gènes réalisés par l’homme avant les OGM |
L’homme réalise des échanges de gènes sur les plantes et les animaux depuis l’invention de l’agriculture, via la sélection puis l'hybridation.
Sélection |
Les plantes que l’homme cultive aujourd’hui ainsi que les animaux dont l’homme pratique l’élevage, n’existaient pas il y a 10 000 ans. Ils sont le fruit d'un processus de domestication initié aux débuts de l’agriculture, vers l’an -8000. Consciemment ou non, l'homme a sélectionné – en choisissant de manger et de cultiver les plantes aux meilleurs rendements (graines les plus grosses, pépins plus petits, goût moins amer, etc.) – certains individus au sein des populations de plantes[53]. En effet, des mutations génétiques spontanées ont lieu en permanence et engendrent des êtres vivants différents. Ainsi, le maïs cultivé est issu de l'introgression de cinq mutations dans le téosinte (ancêtre présumé du maïs initial), qui a transformé la morphologie de la plante en particulier au niveau de la ramification de la plante et de l'attache des grains de maïs à la rafle[54],[55].
Hybridation |
L’hybridation est le croisement de deux individus de deux variétés, sous-espèces (croisement intraspécifique), espèces (croisement interspécifique) ou genres (croisement intergénérique) différents. L'hybride présente un mélange des caractéristiques génétiques des deux parents.
L’hybridation peut être provoquée par l'homme, mais elle peut aussi se produire naturellement[56]. Elle est utilisée, par exemple, pour créer de nouvelles variétés de pommes, en croisant deux variétés existantes ayant des caractéristiques intéressantes[57].
Sélection et hybridation font que la grande majorité des plantes aujourd'hui cultivées de par le monde sont le résultat d’un nombre considérable de mutations génétiques successives les ayant rendu non seulement plus productives mais aussi mieux adaptées à différents usages, à différentes conditions d'exploitations et à leur terroir.
Histoire |
De la génétique au génie génétique |
Au début du XXe, la redécouverte des travaux de Gregor Mendel (1822-1888) et les travaux de Thomas Morgan (1866-1945) sur la mouche Drosophila melanogaster permettent de comprendre que l'hérédité est due à la transmission de particules appelées gènes, disposées de manière linéaire sur les chromosomes. En 1941, deux généticiens américains (George Beadle et Edward Tatum) ont démontré qu’un gène code une protéine donnée. En 1953, les travaux de James Watson, Francis Crick, Maurice Wilkins et Rosalind Franklin, mettent en évidence la structure moléculaire à double hélice de l'ADN. Cette découverte ouvre la voie à une discipline nouvelle, la biologie moléculaire En 1965, la découverte des enzymes de restriction, des protéines capables de découper l’ADN à des sites spécifiques, donnent aux chercheurs les outils qui leur manquaient pour établir une cartographie du génome. Elle ouvre aussi la voie au développement du génie génétique en permettant la « manipulation » in vitro de portions précises d'ADN et donc des gènes. C'est la technologie de l'ADN recombinant, qui permet l'insertion d'une portion d'ADN (un ou plusieurs gènes) dans un autre ADN[58]. Cette découverte est confirmée en 1973 par Paul Berg et ses collaborateurs.
Premiers pas |
Les premiers OGM sont des bactéries transgéniques. La première tentative de transgénèse par l’américain Paul Berg et ses collaborateurs en 1972, consista en l’intégration d’un fragment d'ADN du virus SV40, cancérigène, dans le génome de la bactérie E. Coli présente à l'état naturel dans le tube digestif humain[59],[60]. Cet essai avait pour objectif de démontrer la possibilité de recombiner, in vitro, deux ADN d'origines différentes. L'ADN recombinant ne put être répliqué dans la bactérie[61]. Cependant, devant la puissance des outils à leur portée, les scientifiques inquiets décident lors de la conférence d'Asilomar d’un moratoire qui sera levé en 1977.
En 1977, le plasmide Ti de la bactérie du sol Agrobacterium tumefaciens est identifié. Ce plasmide sert à cette bactérie de vecteur pour transférer un fragment d'ADN, l'ADN-T (ADN de transfert, ou ADN transféré), dans le génome d'une plante. Cet ADN comporte plusieurs gènes dont le produit est nécessaire à la bactérie au cours de son cycle infectieux. Quelques années plus tard cette bactérie sera utilisée pour créer les premières plantes transgéniques[62],[58].
En 1978, une souche de levure (eucaryote) auxotrophe pour la leucine est transformée par un plasmide d'origine bactérienne portant le gène LEU2[63].
En 1978, un gène humain codant l’insuline est introduit dans la bactérie Escherichia coli, afin que cette dernière produise l’insuline humaine. Cette insuline dite recombinante est la première application commerciale, en 1982 du génie génétique[58].L’insuline utilisée actuellement pour traiter le diabète est produite à partir d’OGM[62].
En 1982, le premier animal génétiquement modifié est obtenu. Il s'agit d'une souris géante à laquelle le gène de l'hormone de croissance du rat a été transféré[64]. En 1983, le premier végétal génétiquement modifié est obtenu : un plant de tabac modifié pour résister à un antibiotique, la kanamycine[59]. 1985, voit la première plante transgénique résistante à un insecte : un tabac dans lequel un gène de toxine de la bactérie Bacillus thuringiensis a été introduit[65].
En 2010, le premier organisme contenant un génome intégralement fabriqué par l'homme est décrit dans le journal Science. Il s'agit d'une souche de Mycoplasma capricolum dont le génome a été retiré et remplacé par le génome « JCVI-syn1.0 » conçu par l'équipe de Craig Venter, donnant naissance à une souche Mycoplasma mycoides. Le génome a été créé par la synthèse de 1 078 oligonucléotides de 1 080 paires de bases, ces 1 078 fragments ont été assemblés en 109 fragments de 10 080 paires de bases, eux-mêmes assemblés en 11 fragments de 100 000 paires de bases finalement réunis au sein du génome circulaire de 1 077 947 paires de bases[11],[66].
Évolution du droit |
Louis Pasteur obtint en 1873 le premier brevet pour un organisme vivant, une souche de levure utilisée dans la fabrication de la bière.
En 1977 et 1978, aux États-Unis, seize projets de lois visant à encadrer les pratiques scientifiques liés à la recherche en biologie moléculaire ont été déposés au Congrès. Aucun n'a abouti[67].
En 1980, la Cour Suprême des États-Unis admet pour la première fois au monde le principe de brevetabilité du vivant pour une bactérie génétiquement modifiée. Il s'agit d'une nouvelle bactérie dite oil-eating bacteria mise au point par le docteur Diamond v. Chakrabarty. Cette décision juridique est confirmée en 1987 par l’Office américain des brevets, qui reconnaît la brevetabilité du vivant, à l’exception notable de l’être humain. En 1986, alors qu'est réalisé sur son territoire le premier essai en champ de plante transgénique (un tabac résistant à un antibiotique), la France met en place la Commission du génie biomoléculaire, commission nationale, qui dépend du ministère de l'Agriculture. Elle est responsable du respect des réglementations, contrôle les essais en champs et délivre les autorisations d'essais et de commercialisation des OGM. En 1989, mise en place de la Commission de génie génétique. Celle-ci dépend du Ministère de la Recherche. Elle est chargée d’évaluer les risques liés à l’obtention et à l’utilisation des OGM et de proposer les mesures de confinement souhaitables pour prévenir ces risques.
En 1990, la Commission européenne s’empare de la question des OGM. Elle déclare : « L’utilisation d’aliments modifiés doit s’effectuer de manière à limiter les effets négatifs qu’ils peuvent avoir sur nous ». Elle demande que le principe de précaution, qui implique une longue recherche sur l'innocuité du produit, soit respecté[58].
En 1992, l’Union européenne reconnaît à son tour la brevetabilité du vivant et accorde un brevet pour la création d’une souris transgénique. Elle adopte en 1998 la directive sur la brevetabilité des inventions biotechnologiques : sont désormais brevetables les inventions sur des végétaux et animaux, ainsi que les séquences de gènes.
Le principe d'équivalence en substance apparaît pour la première fois en 1993 dans un rapport de L’OCDE[68].
En 1998, l’Europe adopte une Directive fondamentale relative à la protection des inventions biotechnologiques : sont désormais brevetables les inventions sur des végétaux et animaux, ainsi que les séquences de gènes.
Si les premières autorisations de commercialisation ont entrainé la mise en place d’instances chargées d’évaluer les risques liés aux OGM, Susan Wright[69] écrit en 1994 : « Quand le génie génétique a été perçu comme une opportunité d'investissement, il s'est produit une adaptation des normes et des pratiques scientifiques au standard des entreprises. L'éveil du génie génétique coïncide avec l'émergence d'une nouvelle éthique, radicalement définie par le commerce »[70]
En une vingtaine d'années, en parallèle à l’émergence de la science des biotechnologies et aux enjeux économiques, une branche du droit et des règlementations ont été créés. Les deux secteurs les plus importants pour les brevets sont ceux de la santé et de l'agriculture. Le marché potentiel se chiffre en centaines de milliards de dollars[71].
Les finalités éthiques, économiques et politiques des OGM sont aujourd’hui un enjeu planétaire[58].
Commercialisation progressive |
En 1982, la fabrication d'insuline pour le traitement du diabète est la première application commerciale du génie génétique[58]. L’insuline recombinante est aujourd’hui utilisée par des millions de diabétiques dans le monde[62].
En 1990, le premier produit alimentaire issu du génie génétique est commercialisé aux États-Unis et au Canada ; il s’agit de chymosine, enzyme permettant la digestion spécifique de la caséine et utilisée dans l'industrie agro-alimentaire en tant que substitut à la présure pour cailler le lait.
En 1993, la somatotropine bovine (rbGH ou STbr)[note 1] est autorisée à la commercialisation aux États-Unis par la Food and Drug Administration. Destinée à rendre les vaches laitières plus productives, cette hormone, autorisée aujourd'hui dans de nombreux pays est interdite dans l'Union européenne et au Canada[72]. En août 2008, l'entreprise Monsanto, seule entreprise à commercialiser la STbr sous la marque déposée Posilac annonce son retrait de la fabrication[73].
Produites par des micro-organismes génétiquement modifiées, l'insuline, la chymosine ou l'hormone de croissance bovine, dites « recombinantes » ne sont pas elles-mêmes des OGM[62],[74].
1994 : la première plante génétiquement modifiée est commercialisée: la tomate flavr savr, conçue pour rester ferme plus longtemps une fois cueillie ; elle n'est plus commercialisée depuis 1996 car elle était, selon certains, jugée fade et trop chère par les consommateurs[62]. Cependant, le cas de la tomate flavr savr était en 1998 intégrée dans un procès intenté à l'Agence fédérale américaine des produits alimentaires et médicamenteux par un groupe de défense de consommateurs et qui aboutissait à une condamnation de cet organisme[75].
Depuis, des dizaines de plantes génétiquement modifiées ont été commercialisées dans le monde et, d'après l'OMS leur consommation n’a eu aucun effet sur la santé humaine[note 2].
1995 - 1996 : la commercialisation aux États-Unis par l'entreprise Monsanto du soja « Roundup Ready », résistant à l'herbicide non sélectif Roundup, du maïs « yield gard », résistant à l’insecte foreur de tige du maïs, et du coton « Bollgard », est autorisée[76]. L'association Greenpeace lance une campagne internationale contre la commercialisation d'OGM dans le domaine de l'alimentation et contre leur dissémination dans l'environnement[58].
Le 29 janvier 2000, est signé le Protocole de Carthagène sur la prévention des risques biotechnologiques relatif à la Convention sur la diversité biologique, plus généralement appelé Protocole de Carthagène sur la biosécurité. Sous l'égide de l'ONU, il constitue le premier accord international environnemental sur les OGM. Identifiant leurs spécificités, il est un instrument juridique basé sur les principes de précaution et de prévention que les États peuvent opposer aux règles de l'OMC[77]. Entré en vigueur le 11 septembre 2003, il a recueilli à ce jour 157 instruments de ratifications[78].
En 2000, L'Union européenne fixe à 0,9 % le seuil d'OGM qu'un produit alimentaire européen peut contenir sans être tenu de le signaler sur l’étiquette[58].
En 2001 : À l'occasion du premier Forum social mondial de Porto Alegre, Via Campesina lance un appel international à l’union pour lutter contre les OGM et en faveur des semences paysannes. À la clôture du forum, selon Attac, 184 organisations environ s'engagent à soutenir la lutte de la Vía Campesina à travers le monde et à organiser des actions pour l’arrêt de l’importation et de l’utilisation des OGM[79]
Bien que la culture de maïs transgénique soit autorisée en France jusqu’au 21 mars 2000, les producteurs ont décidé de ne pas en planter pour respecter le choix de leurs clients et des consommateurs. Les magistrats européens de Luxembourg concluent que la France a l’obligation d’autoriser la culture d’OGM sur son territoire sauf si elle peut apporter des informations prouvant que l’aliment présente un risque pour la santé humaine ou pour l’environnement. Ils étendent la durée de l’autorisation de culture à 10 ans, alors que l’arrêté initial la limitait à 3 ans. Le Conseil d’État s’incline devant le droit communautaire. Le 14 décembre, à Montpellier, Greenpeace et plusieurs centaines de personnes, avec José Bové, manifestent contre les OGM à l’occasion de la conférence de l’ONU qui leur est consacrée[58].
Le 13 mai 2003, le gouvernement américain porte plainte devant l’Organisation mondiale du commerce pour forcer l’Union européenne à lever son « moratoire de fait » sur la vente de semences et d’aliments génétiquement modifiés[58].
L'Organisation mondiale du commerce autorise la restriction des importations dans le cas d’une « protection contre les risques pour l’innocuité des produits alimentaires et les risques découlant des espèces envahissantes provenant de végétaux génétiquement modifiés»[80], mais ces conditions ne sont pas réunies, selon l’OMC, pour le différend opposant les pays producteurs (États-Unis, Canada, Argentine) à l’UE[81]. La communauté européenne s’est engagée à respecter les règles de l’OMC, concernant les OGM, avant février 2008[82].
Organismes transgéniques |
Hormis pour la xénobiologie, la possibilité de fabriquer un OGM repose sur le fait que le langage génétique est universel dans tout le monde du vivant connu à ce jour. Du fait de cette universalité, un gène, issus d'un organisme « donneur », peut être introduit dans un organisme « receveur », lequel le prenant à son propre compte, est en mesure de le décoder et ainsi fabriquer la (ou les) protéine(s) qui lui correspond, chacune de celles-ci ayant une fonction. À ce jour, les organismes donneur et receveurs peuvent être de la même espèce (sélection, génie génétique) ou d'espèces différentes (hybridation, génie génétique). Cette simplicité basée sur une interprétation de la théorie fondamentale de la biologie moléculaire s'avère en réalité complexe à mettre en œuvre :
- un gène pourra coder plusieurs protéines ;
- une protéine pourra avoir plusieurs fonctions dans l'organisme receveur ;
- l'expression d'un gène dépend de divers facteurs environnementaux.
- l'universalité du code génétique, ne suffit pas à garantir que l'expression d'un gène d'un organisme s'opèrera ou s'opèrera correctement dans un autre organisme. Un certain nombre d'informations contenues dans les gènes, en particulier les informations épigénétiques, ne sont pas (ou mal) comprises d'une espèce à une autre. Une série de modifications du gène s'avère alors nécessaire. Le transgène introduit in fine n'est donc pas le gène original mais un gène modifié, une « construction génétique artificielle ».
- Une fois exprimée chez l'organisme modifié, la protéine peut faire l'objet de modifications post-traductionnelles nécessaires à sa fonctionnalité, ou encore nécessiter une localisation précise dans la cellule (mitochondrie, chloroplaste, membrane plasmique)
Différentes étapes d'élaboration |
Les différentes étapes de la création d'un OGM sont :
- L'identification et le clonage de la séquence d'intérêt à introduire dans l'organisme cible,
- La réalisation du transgène, c'est-à-dire la molécule d'ADN à introduire dans l'organisme cible, il peut s'agir de la séquence d'intérêt seule, ou d'une séquence comportant plusieurs gènes.
- L'introduction du transgène dans une cellule de l'organisme cible, puis son intégration au génome.
- Dans certains cas une étape de régénération d'un organisme complet est nécessaire (par exemple on peut modifier une cellule végétale à partir de laquelle une plante se développera)
Le dernier point comporte deux étapes essentielles, différentes l'une de l'autre, mais souvent confondues. Le transfert d'une molécule d'ADN dans un organisme et le transfert de cette même molécule dans le génome de l'organisme. Cette confusion est renforcée par l'utilisation du terme vecteur qui désigne à la fois, une molécule d'ADN comportant le ou les gènes d'intérêt (plasmides, transposons, virus (génome)), ou l'organisme vivant (Agrobacterium tumefaciens, virus) qui permet l'introduction du premier vecteur dans l'organisme cible.
Procaryotes, bactéries et archéobactéries |
Les plasmides bactériens présentent l'intérêt d'être faciles à purifier et à modifier pour y intégrer de nouveaux gènes. Le plasmide transformé est incorporé dans les bactéries où il reste distinct de l'ADN chromosomique (sauf dans le cas des épisomes), tout en étant capable d'exprimer un ou plusieurs gène(s) d'intérêt. Le plasmide modifié comporte généralement un gène de résistance à un antibiotique, qui est employé comme marqueur de transformation (ou de sélection). Ainsi, seules les bactéries ayant incorporé le plasmide sont capables de croître dans un milieu comportant l'antibiotique correspondant.
Grâce aux capacités importantes de multiplication des bactéries (Escherichia coli double sa population toutes les 20 minutes), il est possible par cette technique de disposer de la séquence génétique d'intérêt en grande quantité. En revanche, la spécificité des systèmes plasmidiques limite les bactéries capables d'incorporer le plasmide modifié. D'autre part la stabilité de la transformation par plasmide est dépendante de la nécessité de la cellule à conserver ce plasmide, c’est-à-dire la bactérie ne conserve le plasmide acquis que si celui-ci lui confère un avantage sélectif, généralement il s'agit de la résistance à un antibiotique. Si ces bactéries sont cultivées en absence de l'antibiotique, elles auront tendance à ne pas conserver le plasmide, on dit alors qu'il faut exercer une pression de sélection pour que les bactéries le maintiennent. Certaines archaea peuvent également être transformées par un plasmide, mais les méthodes de biologie moléculaire associées à ces organismes sont encore peu développées.
Les épisomes sont des plasmides possédant certains gènes supplémentaires permettant la synthèse d'enzymes de restriction qui mènent à son intégration aux chromosomes bactériens par une recombinaison épisomale. Une fois intégré au chromosome de la cellule, la transmission du ou des caractères génétiques est assurée lors de la mitose de cellules mères en cellules filles, contrairement aux plasmides qui se répartissent de façon aléatoire.
Un autre moyen de procéder à une transformation de bactéries avec intégration d'ADN, est d'utiliser des transposons. Chez certaines bactéries, ces transposons actifs peuvent véhiculer et faire intégrer le gène d'intérêt.
Certains virus sont également capables d'infecter des bactéries ou des archaea, et d'intégrer une partie de leur génome dans le génome de leur hôte.
Eucaryotes (plantes, animaux, champignons) |
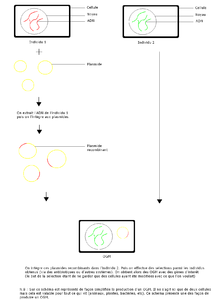
Schéma de production d'un OGM.
Vecteur génétique |
Comme pour les bactéries, il est nécessaire d'utiliser des vecteurs génétiques pour introduire les séquences d'ADN d'intérêt dans le génome de l'organisme à modifier. De nombreux types de vecteurs existent suivant l'organisme cibles, par exemple:
Plasmides : Il existe également des plasmides pouvant être introduits dans des organismes eucaryotes. Ceux-ci peuvent être soit maintenus dans les cellules, soit intégrés (au moins en partie) au génome de l'organisme cible.
Transposons : cette séquence d'ADN transposable est utilisée avec un transgène auquel ont été ajoutés à ses extrémités des sites de reconnaissance de l'ADN. La taille du transgène doit être limitée. Les techniques à base de transposons sont employées essentiellement sur la drosophile.
Transfert du matériel génétique dans l'organisme cible |
Transfert indirect d'ADN ou transfert biologique |
Les séquences d'ADN d'intérêt (ADN), étranger à l'organisme, peuvent être introduites dans l'organisme de destination par l'intermédiaire d'un autre organisme vivant :
Les principales techniques employées sont les suivantes :
Agrobacterium tumefaciens : cette bactérie possède un plasmide (appelé plasmide Ti) dont une portion d'ADN (l'ADN-T pour ADN Transférable) est capable de s'intégrer dans le génome des plantes, ce qui en fait le vecteur le plus largement employé pour la création de végétaux transgéniques. Le transgène est intégré dans le plasmide de cette bactérie, qui le véhicule jusqu'à l'ADN chromosomique de l'hôte. Plusieurs méthodes existent pour transformer une plante à l'aide d'Agrobacterium tumefaciens:
- La bactérie peut être infiltrée dans les feuilles, ou pénétrer au niveau d'une blessure.
- Le « trempage » des fleurs dans une solution d'Agrobacterium tumefaciens. Cette méthode présente l'intérêt d'intégrer le transgène dans les cellules germinales (pollen et ovules) et donc d'obtenir une descendance transgénique.
- La transformation de culture de cellules végétales indifférenciées (« cals ») par Agrobacterium tumefaciens. Il faut ensuite régénérer des plantes à partir de ces cals.
Rétrovirus : ces virus ayant la capacité d'intégrer leur matériel génétique dans les cellules hôtes pour développer l'infection, des vecteurs ont été élaborés en remplaçant les gènes permettant l'infection par un transgène. Toutefois, les rétrovirus sont très spécifiques à leur hôte, et ces vecteurs ne peuvent accepter de transgène de taille trop grande.
Transfert direct d'ADN |

Canon à ADN
Des organismes dont les membranes sont fragilisées ou des cellules végétales dépourvues de parois (telles les protoplastes) sont mis en contact avec de l'ADN. Puis un traitement physique ou chimique permet l'introduction de l'ADN dans les cellules. D'autres techniques telles que la micro-injection, la macro-injection et d'autres techniques de biolistique permettent l'introduction mécanique de l'ADN dans les cellules.
Croisement et fusion cellulaire |
Le plus ancien des modes de transfert de matériel génétique utilisé par l'homme est le croisement entre individus. Cela peut être réalisé entre individus de même espèces ou d'espèces proches (hybrides). L'un ou les deux individus peuvent être des individus transgéniques, ceci est particulièrement utilisé pour réunir plusieurs traits modifiés en un seul individu.
La fusion cellulaire (y compris la fusion de protoplastes) qui aboutit à des cellules vivantes présentant de nouvelles combinaisons de matériel génétique héréditaire sont constituées par la fusion de deux cellules ou davantage au moyen de méthodes qui ne sont pas mises en œuvre de façon naturelle.
Intégration du matériel génétique dans le génome de l'organisme modifié |
Le matériel génétique transféré à l'organisme modifié, peut être contenu dans un plasmide qui sera conservé tel quel, dans ce cas il n'y aura pas d'intégration au génome au sens propre. Dans les autres cas le transgène sera intégré par recombinaison au génome de l'organisme.
Gènes utilisés |
La liste des gènes qui peuvent être utilisés est virtuellement infinie, mais il est possible de définir différentes grandes catégories de gènes.
Gènes marqueurs |
Il s'agit là, non de caractéristique que l'on souhaite conférer à l'organisme, mais d'artifice technique permettant d'identifier et de trier les cellules dans lesquelles la construction génétique voulue a été introduite, de celles où l'opération a échoué.
Les gènes de résistance aux antibiotiques sont utilisés comme marqueurs de sélection simples et pratiques : il suffit en effet de repiquer les cellules dans un milieu contenant l'antibiotique, pour ne conserver que les cellules chez lesquelles l'opération a réussi. Les gènes de résistance aux antibiotiques utilisés (que l'on peut toujours trouver dans certaines PGM actuellement) étaient ceux de la résistance à la kanamycine/néomycine, ampicilline et streptomycine. Leur choix s'est imposé naturellement, par le fait qu'ils étaient d'usage courant pour s'assurer de la pureté des cultures microbiennes, en recherche médicale et en biologie, et peu, voire pas utilisés en médecine humaine. Depuis 2005, ils sont interdits pour tout nouvel OGM.
Pour ne plus laisser en place que le gène d'intérêt, de manière à être sûr que les gènes de résistance n'interfèrent pas avec le phénotype observé, deux méthodes sont possibles : une méthode d'excision de ces cassettes « gènes de résistance » et la transgénèse avec un système binaire (deux plasmides : l'un portant la cassette « gène d'intérêt », l'autre la cassette « gène marqueur ». Dans la descendance des plantes GM obtenues, seules celles qui possèdent la cassette « gène d'intérêt » sont retenues.
Gènes de résistances |
La résistance aux insectes est conférée aux plantes par des gènes codant une forme tronquée de protéines endotoxines, fabriquées par certaines souches de Bacillus thuringiensis (bactéries vivant dans le sol). Il existe de multiples toxines, actives sur différents types d'insectes : par exemple, certaines plantes résistantes aux lépidoptères, tels que la pyrale du maïs (Ostrinia nubilalis), portent des gènes de type Cry1(A).
Pour la résistance aux herbicides sont utilisés des gènes conférant une tolérance au glufosinate d'ammonium (dans le Liberty Link) et au glyphosate (dans le Roundup Ready).
Gène de stérilité |
Le gène de stérilité mâle (barnase) code une ribonucléase qui s'oppose à l'expression des molécules d'acide ribonucléique nécessaires à la fécondité. Il est contrôlé de façon à ne s'exprimer que dans le grain de pollen. Le gène barstar, quant à lui, est un inhibiteur de cette ribonucléase, et rend sa fertilité au pollen. La combinaison des deux gènes permet, par exemple, d'empêcher l'autofécondation dans une variété pure porteuse de barnase, mais d'autoriser la production de graines par un hybride de cette variété et d'une autre, porteuse de barstar. Ainsi, on peut obtenir de semences hybrides homogènes (utilisé pour des salades en Europe), ou empêcher le réemploi des graines.
La technologie « Terminator » s'agit en fait d'un « système de protection technologique », breveté par la société Delta & Pine Land et le ministère américain de l'Agriculture. Cette technologie permet la modification génétique de semences pour empêcher la germination de la génération suivante de semences. Il ne s'agit pas de stérilité au sens strict du terme puisque les plantes sont capables de produire des graines, c'est la germination de celle-ci qui est inhibée. Cette technologie a été surnommée Terminator par ses opposants[83].
Gènes antisens ou sens bloquant la traduction d'autres gènes |
L'opération consiste à introduire un exemplaire supplémentaire d'un gène donné, mais en orientation inverse (on parle alors de gène « antisens »), ou, parfois, dans le même sens, mais tronqué. La présence de ce gène « erroné » induit le phénomène d'interférence par ARN et diminue de manière drastique la quantité d'ARN correspondant, ce qui diminue la synthèse de l'enzyme codée par ce gène. Un exemple de ce type est celui de la variété de pomme de terre Amflora, dont les synthétases sont produites en quantités limitées, de façon à produire un amidon différent en inhibant la synthèse d'amylose.
Gènes rapporteurs |
En recherche fondamentale les gènes peuvent être modifiés pour étudier le profil d'expression et/ou la localisation de la protéine associée. Pour cela le gène d'intérêt est fusionné à un gène rapporteur (gène codant une protéine fluorescente comme la GFP ou encore une enzyme dont l'action peut être visualisée comme la bêta-glucuronidase).
Production de protéines |
Dans certains cas le but d'un OGM sera la production en grande quantité d'une protéine d'intérêt, également appelée protéine recombinante dans ce cas. Les plus connues étant l'insuline, l'hormone de croissance ou encore le facteur VIII.
Dans ce cas une cellule isolée (bactérie, levure, cellule d'ovaire de hamster chinois (en)) ou un organisme entier (tabac), a reçu un transgène codant la protéine d'intérêt. Les cellules isolées sont tout d'abord cultivées en bioréacteur, puis une phase de purification de la protéine d'intérêt a lieu. Une des méthodes de purification les plus répandues est l'utilisation de la technique de chromatographie, que ce soit d'affinité, échangeuse d'ions ou de partage.
Principales applications |
Les OGM sont utilisés dans les domaines de la recherche, de la santé, de la production agricole, et de l'industrie[84].
Recherche fondamentale |
En recherche fondamentale, l'obtention d'OGM n'est pas forcément un but mais le plus souvent un moyen de trouver des réponses à certaines problématiques : comment les gènes contrôlent-ils le développement d'un embryon ? Quelles sont les étapes de division de la cellule ? À quoi correspond chaque moment de son développement ?
L'inactivation d'un gène est une méthode utilisée en laboratoire pour comprendre le rôle et le fonctionnement de ce gène. Dans certains cas cette inactivation se fait par transgénèse en insérant un fragment d'ADN à la place du gène à étudier[85].
Gènes du développement et évolution |
Par exemple, en transférant un gène de souris chez la drosophile, on a pu montrer qu'en plus d'une similarité de séquence il y avait une similarité de fonction entre certains gènes de deux espèces. Ainsi le gène Hox-b9 de souris a été transféré dans un embryon de drosophile ce qui a modifié son plan d'organisation faisant apparaitre une ébauche de patte à la place des antennes[86]. On obtient le même résultat si on mute le gène Antennapedia de la drosophile. Il y a donc une fonction semblable pour ces deux gènes : ils contrôlent le développement embryonnaire chez ces deux espèces. On montre ainsi que les mécanismes d'expression génique lors du développement embryonnaire sont les mêmes chez ces deux espèces, ce qui met en évidence le lien de parenté et un des processus de l'évolution des espèces.
Cartographie et séquençage des génomes |
Les séquençages des génomes humain et d'autres espèces, comme ceux de Drosophila melanogaster ou d'Arabidopsis thaliana[87], ont été conduits dans un contexte de recherche fondamentale avec comme objectif à terme des applications médicales.
L'analyse de génomes entiers nécessite la constitution de « banques génétiques »[88], c'est-à-dire des dispositifs matériels dans lesquels l'ADN à analyser est « rangé » et disponible. L'ADN de l'espèce à étudier est découpé puis inséré dans le génome de micro-organismes (bactéries ou virus). Chacun de ces micro-organismes constitue un clone contenant une portion précise de l'ADN, ce qui permet de le manipuler à tout moment. Ceci permet d'identifier des gènes et de connaître leur position sur les chromosomes. Enfin cela aboutit au séquençage complet du génome.
Localisation cellulaire du produit d'un gène |

visualisation au microscope confocal de protéines kinase fusionnées à la GFP et localisées dans les cellules de garde des stomates
Une des applications majeures des OGM en recherche fondamentale est l'analyse de la localisation de la protéine produite à partir d'un gène donné. Le schéma expérimental classique de ce type d'étude est le remplacement de la (ou les) copies sauvage(s) du gène étudié par une version codant la même protéine fusionnée à une seconde protéine qui peut être observée facilement, telle que la GFP.
Le recours à un organisme génétiquement modifié pour de telle expérience permet de s'assurer que la protéine fusionnée est fonctionnelle. Le processus est effectué dans un organisme mutant chez lequel le gène d'intérêt est altéré, si l'organisme recouvre un phénotype sauvage grâce à l'insertion du gène codant la protéine de fusion, alors il est considéré que la fusion n'a pas altérée la fonction du gène et que par conséquent la localisation observée est pertinente.
Domaine médical |
Domaine existant |
Les premiers organismes génétiquement modifiés ont permis la production de substances médicales : insuline utilisée pour soigner le diabète, hormone de croissance humaine utilisée pour soigner certaines formes de nanisme, vaccins anti-hépatite B fabriqués à partir de levures et de cellules d'ovaires de hamster (CHO)[89].
Aujourd'hui[Quand ?], si l'effort de recherche existe toujours dans ces domaines, un pôle très attractif commercialement se développe avec la production d'alicaments. Des aliments enrichis en substances médicamenteuses dans le lait de mammifères existent d'ores et déjà[89].
Recherche en cours |
Les OGM représenteraient une technologie d'avenir pour la médecine et l'industrie pharmaceutique du fait de leur potentiel d'amélioration variétale[note 3]. Le génie génétique pourrait, par exemple, permettre de lutter contre certaines maladies en mettant en œuvre de nouveaux procédés d’obtention de produits thérapeutiques tels que des anticorps dans le traitement des cancers[84]. Supprimer les gènes de résistance à un antibiotique utilisé actuellement en gène de sélection[90] est un enjeu majeur des recherches actuelles.
Moléculture |
Depuis l'enrichissement de certains de nos aliments en éléments favorables à la santé à la fabrication de médicaments consommés sous forme d'aliments, la frontière est difficile à discerner. L'effort de recherche est très accentué dans ces domaines frontaliers dont les produits sont dénommés par l'industrie agro-alimentaire : alicaments. Ils se portent sur les différents moyens de production des molécules à usages thérapeutiques. Parmi ces moyens de productions, on trouve[91] :
- La culture en plein champ de végétaux modifiés pour fabriquer des molécules à usage thérapeutique (c'est par exemple le cas d'un maïs génétiquement modifié afin de lui faire produire de la lipase gastrique, enzyme produite par le pancréas et qui permet la digestion des graisses -l'insuffisance pancréatique affecte principalement les patients atteints de mucoviscidose et de pathologies du pancréas-), ou améliorés d'un point de vue nutritif comme le riz doré synthétisant du β-carotène[92].
- L'utilisation de cellule dans le contexte naturel, qu'est l'animal entier génétiquement modifié : sang, lait, liquide séminal, urine, soie mais aussi blanc d'œuf[89].
L’un des domaines les plus prometteurs du point de vue de la rentabilité est la transgénèse appliquée aux espèces laitières, puisque le lait est facile à « récolter » en grande quantité[93]. Le premier cas de moléculture animale fut une brebis GM développée pour synthétiser dans son lait de l’a-antitrypsine, une protéine utilisée pour soulager l’emphysème chez l’humain. Le transgène codant de cette molécule a pu être isolé chez l'humain, puis introduit dans le génome de la brebis[93].
La possibilité de produire des médicaments dans des cellules d'insectes apparaît comme une voie importante à Gérard Devauchelle, de l'Unité de Recherches de Pathologie Comparée à l'INRA de Montpellier qui prédit que : « Dans les années à venir c'est certainement ce genre de méthode qui permettra d'obtenir des molécules à usage thérapeutique pour remplacer celles qui aujourd'hui sont extraites d'organes. »[89].
L'utilisation d'un procédé plutôt qu'un autre sera déterminée par son efficacité au cas par cas[89].
Xénogreffe |
L'idée d'utiliser des organes d'animaux pour des greffes humaines est ancienne. Le porc, qui présente le double avantage d'être à la fois physiologiquement assez proche de l'espèce humaine et de n'avoir que très peu de maladies transmissibles à celle-ci, est considéré par les spécialistes comme le meilleur donneur d'organes possible. Des porcs transgéniques, pourraient fournir des organes « humanisés ». Cette approche thérapeutique présente un réel intérêt mais nécessite encore des travaux de recherche approfondis, notamment dans la découverte de gènes inhibateurs des réactions de rejet[89].
Thérapie génique |
La thérapie génique consiste à transférer du matériel génétique dans les cellules d’un malade pour corriger l’absence ou la déficience d’un ou de plusieurs gènes qui provoque une maladie. Elle est encore en phase de recherche clinique[94].
Végétaux génétiquement modifiés et utilisés dans l'agroalimentaire |
Domaine existant |
| Dans les pays industrialisés | dans les pays moins avancés | |
|---|---|---|
| Tolérance aux herbicides | 29 | 37 |
| Résistance aux insectes | 18 | 29 |
| Qualité du produit | 16 | 6 |
| Gènes ajoutés | 12 | 10 |
| Résistance aux virus | 8 | 10 |
| Propriétés agronomiques (rendement, tolérance à la sécheresse, etc.) | 5 | 1 |
| Résistance aux champignons/bactéries | 5 | 3 |
| Autres | 6 | 4 |
Les principales plantes cultivées (maïs, riz, coton, colza, betterave, pomme de terre, soja), ont des variétés génétiquement modifiées. On trouve aussi des tomates, des œillets, de la chicorée, du tabac, du lin, des fraises, des bananes, des choux, des choux-fleurs, du guayule mais ces espèces mineures ne font pas forcément l'objet de commercialisation et certaines ne sont pas sortie des laboratoires. Les OGM commercialisés concernent essentiellement des plantes cultivées à très grande échelle et présentant des enjeux techniques précis[96],[97].
Les premières plantes génétiquement modifiées (PGM) le furent pour être rendues tolérantes à un herbicide. Aujourd'hui, du maïs, du soja, du coton, du canola, de la betterave sucrière, du lin[98] sont génétiquement modifiées pour résister à une molécule contenue dans des herbicides totaux, le glyphosate.
Une autre perspective a conduit à l'élaboration de plantes sécrétant un insecticide. Le maïs Bt, le coton Bt doivent leur nom à Bacillus thuringiensis, un bacille produisant des protéines insecticides et qui confère à ces plantes une résistance aux principaux insectes qui leur sont nuisibles, notamment la pyrale du maïs, dans le cas du maïs, ou la noctuelle de la tomate, dans le cas du coton.
Des aliments transformés (huiles, farines, etc.) issus de matières premières génétiquement modifiées sont également commercialisables[84].
Recherches en cours |
Une troisième voie consiste à produire des plantes cultivées génétiquement modifiées pour augmenter leurs qualités nutritives (riz doré) ou leur capacité de résistance aux variations de climat (sécheresse, moussons, etc.)[99],[100]. Dites OGM de 2e génération, ces céréales sont toujours en développement.
La recherche s'oriente aujourd'hui vers la modification de plusieurs traits dans une seule plante génétiquement modifiée. Par exemple le gouvernement chinois pilote un projet visant l'amélioration de la qualité nutritive d'un riz, mais également son adaptation aux environnements stressants (sécheresse, salinité, etc.). Ce riz, nommé GREEN SUPER RICE, devrait également comporter plusieurs gènes de résistances à des insectes et maladies[101].
La suppression des gènes de résistance à un antibiotique utilisés en gène de sélection ainsi que l'élimination des substances toxiques produites naturellement par certaines plantes sont des axes énoncés des recherches en cours[84].
Animaux génétiquement modifiés et utilisés dans l'agroalimentaire |
Recherches en cours |
En 2011, le journal Science rapporte la création de poulets génétiquement modifiés pour inhiber l'activité de la polymérase du virus de la grippe aviaire. Cette inhibition empêche le virus de passer la phase de réplication virale et empêche donc sa propagation dans l'élevage de volailles[102].
Utilisation pour l'industrie |
Domaine existant |
Les OGM permettent la production de matières premières à destination de l’industrie : des peupliers OGM ayant un taux de lignine moindre ont été obtenus, facilitant le processus de fabrication de la pâte à papier en réduisant l'utilisation des produits chimiques nécessaires pour casser la fibre du bois.
Néanmoins, devant le peu de demande des papetiers, cette production devrait se tourner vers la production de bioéthanol[103],[104].
Actuellement, les biotechnologies employant des enzymes permettent de traiter les eaux usées industrielles[84].
Amflora |
En mars 2010, la Commission européenne a décidé, dans la mesure où le Parlement n'avait pu aboutir à une décision, par la voix du commissaire à la Santé et à la Politique des consommateurs John Dalli, d'autoriser la culture de la pomme de terre transgénique Amflora. Celle-ci est destinée à la production de fécule de pomme de terre pour l'industrie du textile, des adhésifs ou du papier. Est visée une amélioration de la productivité par une économie réalisée sur la production de la matière première, l'amidon. Son autorisation est validée par la directive 2001/18/CE (dite « sur la dissémination volontaire d'OGM »). Son utilisation par l'industrie agro-alimentaire n'est pas prévue, mais la présence non voulue de résidus de cette pomme de terre dans des produits destinés à la consommation (dans la limite de 0,9 %), fait l'objet d'une autorisation complémentaire dépendant du règlement 1830/2003/CE, dit « sur la traçabilité des OGM », et du règlement 1829/2003/CE, dit « sur l'étiquetage des OGM »[105].
BASF Plant Science a cependant annoncé en janvier 2012 l'arrêt de commercialisation d'Amflora en Europe, en raison du manque d'intérêt industriel pour celle-ci.
Recherche en cours |
Des recherches portent sur des plantes ou des micro-organismes génétiquement modifiés permettant de dépolluer les sols contaminés et plus généralement d’éliminer les contaminants de l’environnement (pièges à nitrates, etc.)[84].
Certaines recherches visent également à produire à bas coût des matériaux rares ou dispendieux, par exemple des hydrocarbures à partir de nutriments banals. Ainsi, une entreprise française implantée dans le Génopole d'Évry (Essonne) a annoncé le 6 octobre 2010 avoir fabriqué des bactéries capables de synthétiser de l'isobutène à partir de glucose[106].
Réglementation et utilisation des OGM à travers le monde |
La réglementation des organismes génétiquement modifiés est très variable selon les pays ; des mesures juridiques très diverses ont été prises dans le monde concernant la recherche, la production, la commercialisation et l'utilisation des OGM, dans leurs divers domaines d'application (agricole, médical, etc.). La réglementation en Europe est plus restrictive qu’en Amérique du Nord et dans les pays émergents, en ce qui concerne leur exploitation agricole, leur commercialisation et leur consommation alimentaire.
Sécurités sanitaires européennes |
Dans l'Union européenne, la règlementation organisant la présence d'un OGM sur le marché de l'alimentation est soumise à la directive 2001/18/CE[107] modifiée et précisée par les règlements 1830/2003/CE et 1829/2003/CE[108]. La directive 2001/18/CE (dite « sur la dissémination volontaire d'OGM ») règlemente la dissémination volontaire des OGM dans l’environnement (cultures en champs à vocation expérimentale ou commerciale, transport, manutention, etc.). Le règlement 1830/2003/CE[109] (dit « sur la traçabilité des OGM ») s'applique aux OGM destinés à la commercialisation sous forme soit de denrées alimentaires pour l'humain ou l'animal, soit de produits industriels. Sont concernés par ce règlement les semences génétiquement modifiées, leurs produits, les dérivés de ces produits. En sont exclus les OGM destinés à l'usage médical et vétérinaire. Il est relayé par le règlement 1829/2003/CE[110] (dit « sur l'étiquetage des OGM »).
Procédure d'autorisation |
Marché d'OGM en tant que produits |
Dans l'Union européenne, lorsqu'une entreprise désire commercialiser une plante génétiquement modifiée en tant que produits ou éléments de produits, elle s'adresse à l'un des gouvernements d'un pays européen. Celui-ci, par l'intermédiaire de l'autorité de sécurité sanitaire compétente autochtone, étudie le dossier fourni par l'entreprise. En France, cette compétence relève de l'AFSSA[111] qui travaille en collaboration avec la Commission du génie biomoléculaire[112]. À l'issue de cette observation, l'autorité de sécurité sanitaire dudit gouvernement émet un avis qui peut être favorable ou non. En cas d'avis non favorable, l'entreprise peut saisir l'autorité compétente d'un autre état qui pourra à son tour émettre un avis indépendant du premier. Dans le cas d'un avis favorable, l'État qui a reçu la demande (appelée « notification ») et a émis le rapport informe les autres États membres par le biais de la Commission européenne. Ces institutions examinent à leur tour le rapport d'évaluation, émettent éventuellement des observations et/ou des objections. En l'absence d'objection, l'autorité compétente ayant réalisé l'évaluation initiale accorde l'autorisation de mise sur le marché du produit. Celui-ci est mis sur le marché de l'ensemble de l'Union européenne, dans le respect des conditions éventuelles imposées par l'autorisation. L'autorisation a une durée maximale de dix ans et peut être renouvelée sous certaines conditions. En présence d'objection(s), la procédure prévoit une phase de conciliation entre les États membres, la Commission et le notifiant (l'entreprise). Si, au terme de la phase de conciliation, des objections sont maintenues, la Commission sollicite l'avis de l'EFSA[113]). Celle-ci examine à nouveau le rapport et formule un avis[114]. La Commission soumet alors un projet de décision au comité de règlementation, composé de représentants des États membres. Si ce comité émet un avis favorable, la Commission adopte la décision. Dans le cas contraire, le projet de décision est transmis au Conseil des ministres pour adoption ou rejet à la majorité qualifiée. Le Conseil doit agir dans un délai de trois mois, sinon, la Commission adopte la décision.
Au 19 janvier 2012, 35 OGM destinés à l’alimentation humaine et animale ou/et à l’importation et la transformation sont autorisés dans l'Union européenne : 25 maïs, 3 cotons, 3 sojas, 2 colzas, 1 pomme de terre, 1 betterave[115].
Dissémination expérimentale dans l'environnement |
Une entreprise désirant introduire un OGM à titre expérimental dans l'environnement doit obtenir l'autorisation écrite de l'autorité nationale compétente de l'État membre sur le territoire duquel la dissémination expérimentale aura lieu. Cette autorisation est délivrée sur la base d'une évaluation des risques que présente la OGM pour l'environnement et la santé humaine. Les autres États membres, ainsi que la Commission européenne, peuvent émettre des observations que l'autorité nationale compétente examinera[108].
Au 1er mai 2008, quatre plantes génétiquement modifiées destinées à la culture sont autorisées. Il s'agit du maïs MON 810 de Monsanto, du maïs T25 de Bayer, tolérant un herbicide et de 2 œillets de Florigène[115]. En juin 2009, l'autorisation de culture du MON 810, valable dix ans, ayant expiré, l’Union européenne l'a renouvelée. En 2010, la pomme de terre Amflora a été autorisée[108].
En 2004, une enquête des Amis de la Terre, une ONG, relève la possibilité de conflits d'intérêts au sein de l'EFSA et soulève le problème de l'indépendance de ce comité d'évaluation[116]. En juillet 2009, Corinne Lepage, membre-fondatrice du Comité de recherche et d'information indépendantes sur le génie génétique (CRIIGEN), association d'étude de l'impact des techniques génétiques sur le vivant, souligne que l'EFSA se prononce sur des études dont les « données restent classées confidentielles, malgré le texte de la directive communautaire sur les OGM »[117]. L'EFSA dément régulièrement ces accusations[118] et a déjà fourni des données à des laboratoires ou organisations indépendantes.
L'utilisation des OGM est autorisée dans tous les pays du monde, sur la base de résultats expérimentaux ne montrant aucun danger pour la santé humaine et animale. D'une façon générale, le principe de l'équivalence en substance est le point de départ de l'évaluation de la sécurité du produit. La plante non-OGM est comparé à la plante OGM car toutes les plantes possèdent des qualités toxiques et/ou allergiques. L'évaluation permet de s'assurer que la modification ne va pas induire des effets toxiques et/ou allergéniques nouveaux (ou augmenter ces effets). Cependant, des tests toxicologiques sont également effectués en complément. Ces tests permettent de s'assurer de l'innocuité des OGM. Dans de nombreux pays européens dont la France, le principe de l'équivalence est appliqué et est également un élément dans l'évaluation globale : les OGM reçoivent un avis favorable si tous les tests mis en œuvre (dont ceux de toxicologie et d'allergénicité) n'indiquent pas un danger éventuel. À ce jour, les études toxicologiques et d'allergénicité tendent à prouver que les OGM destinés à la consommation sont sans danger pour la santé humaine et animale (Herouet 2003[119], Herouet et al. 2005[120], Herouet-Guicheney et al 2009[121]). Certains scientifiques contestent la validité de ces tests, leur reprochant de ne pas être assez inquisiteurs. C'est le cas de Séralini et al., qui s'appuient pour ce faire sur une analyse de tests toxicologiques du maïs MON 863[122]. Les agences sanitaires chargées de la gestion scientifique des risques alimentaires répondent que leurs objections ne sont pas fondées[123]. Fin 2018, la publication des résultats de trois nouvelles études menées aux niveaux européen (GRACE et G-TwYST) et français (GMO90+) infirment les conclusions de Gilles-Éric Séralini en confirmant l'absence d'effets sur la santé des maïs porteurs de MON 810 et NK 603[124].
L’Organisation mondiale du commerce autorise la restriction des importations dans le cas d’une « protection contre les risques pour l’innocuité des produits alimentaires et les risques découlant des espèces envahissantes provenant de végétaux génétiquement modifiés. »[80], mais ces conditions ne sont pas réunies, selon l’OMC, pour le différend opposant les pays producteurs (É-U, Canada, Argentine) à l’UE[81]. La communauté européenne s’est engagée à respecter les règles de l’OMC, concernant les OGM, avant février 2008[125].
Surfaces cultivées |

Zones de culture d'OGM végétaux en 2005 ; En orange, les 5 pays cultivant plus de 95 % des OGM agricoles commercialisés en 2005, en hachurés, les autres pays commercialisant des OGM en 2005. Les points désignent les pays autorisant des expérimentations en plein champ
En 2017, selon l'Isaaa, 18 millions d’agriculteurs répartis dans 26 pays, dont 90 % sont des agriculteurs de pays en développement, auraient cultivé 189,8 millions d'hectares de cultures génétiquement modifiées, contre 185,1 millions en 2016[126]. Les 10 pays ayant le plus produit en 2013 sont les États-Unis (40 %), le Brésil (23 %), l’Argentine(14 %), l’Inde (6,3 %), le Canada (6,2 %), la Chine (2,4 %), le Paraguay, l’Afrique du Sud, le Pakistan et l'Uruguay. Toujours selon l’Isaaa, la part des cultures d’OGM dans la production agricole de l'Union européenne, une des plus importantes au monde, est très faible : 148 013 ha dans cinq pays, surtout en Espagne : 136 962 ha ; cette surface a augmenté de 15 % en 2012, et de 56 % par rapport à 2009 (94 708 ha)[127]. Cette surface est actuellement réduite à deux pays... alors qu'officiellement jusqu'à 9 pays de l'Union européenne ont, un jour, cultivé des plantes transgéniques. En 2016, la surface transgénique européenne était de 136 338 hectares, elle est passée à 130 571 hectares en 2017, soit une diminution de 4,3 %[128].
Débats |
Les débats sur les OGM sont développés autour de plusieurs axes tel que les questions d'ordre scientifique (risques sanitaires et environnementaux, pollution génétique), d'ordre éthique (modification du vivant) ou encore d'ordre agro-économique (brevet sur le vivant, monopoles).
Risques sanitaires |
Selon le Commissariat général au développement durable, « en matière d’impact sanitaire des organismes génétiquement modifiés (OGM), et plus particulièrement des Plantes Génétiquement Modifiées (PGM), différentes positions s’expriment au sein de la communauté. Certains scientifiques du domaine des biotechnologies considèrent qu’il n’y a pas lieu de débattre des OGM d’un point de vue sanitaire ; d’autres estiment en revanche que les études actuellement exigées avant la commercialisation garantissent un haut niveau de sécurité sanitaire mais appellent à la vigilance pour détecter d’éventuels signaux faibles d’effets sanitaires potentiels ; certains enfin considèrent que les connaissances scientifiques ne permettent pas de statuer sur les effets à long terme de la consommation d’OGM »[129].
En 2003, le Conseil international pour la science concluait que, d'après une revue des résultats de 50 études évaluées par d'autres scientifiques et publiées entre 2002 et 2003, après que des OGM ont été mis en culture pour l'alimentation, il n'y a pas de preuves que les aliments génétiquement modifiés soient dangereux pour la santé humaine, même si les effets de long terme restent inconnus, comme pour la plupart des autres produits alimentaires[130].
En 2012, un groupe de scientifiques sous la direction de Gilles-Éric Séralini, financé par des fondations regroupant des acteurs comme les groupes Carrefour et Auchan[131],[132], publie un article intitulé Long term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize dans lequel ils affirment que l'ingestion de maïs génétiquement modifié NK 603 et/ou de l'herbicide Roundup a des effets tumorigènes et toxiques[133]. Cet article est accompagné d'une forte couverture médiatique[134],[135]. Rapidement, de nombreux scientifiques[136],[137]
critiquent la méthodologie et les conclusions de l'étude[138],[139]. S'appuyant sur les avis des autorités sanitaires belge[140], allemande[141], danoise[142], française[143], italienne et néerlandaise[144], l'Autorité européenne de sécurité des aliments (EFSA) estime que cette étude est de qualité scientifique insuffisante pour des évaluations de sécurité[145]. Fin 2013 la revue retire l'étude, constatant que les résultats, même s'ils ne sont pas frauduleux, ne soutiennent pas les conclusions des auteurs et ne permettent aucune conclusion[146].
À la suite de cette étude, le gouvernement français a demandé une évaluation de sûreté sur le long terme, visant notamment à évaluer le caractère prédictif des études de 90 jours[147]. L'appel d'offres précise que les scientifiques devront se conformer au standard de l'OCDE « TG453 ». Ce standard décrit le protocole des études des effets à long terme des substances chimiques depuis 1981, l'EFSA l'a rendu applicable aux aliments entiers[148].
Il est à noter que ce document de l'EFSA confirme le besoin impératif d'un minimum de 50 animaux par sexe et par dose pour tester les éventuels effets cancérigènes, et qu'il décrit les limites de ces tests chez les souches d'animaux à forte incidence de cancer : la prévalence ne doit pas dépasser 45 % chez les témoins, ce qui est le cas des rats Sprague-Dawley[149],[150],[151] où elle peut atteindre 95 %.
En janvier 2014 la revue Food and Chemical Toxicology, qui avait publié puis retiré les travaux de Séralini, publie une étude chinoise qui respecte la ligne directrice TG 453 et montre l'absence d'effet d'un riz OGM à long terme (72 semaines)[152].
L'évaluation des risques environnementaux et sanitaires potentiellement induits par la dissémination d'OGM dans l'environnement et par leur utilisation dans l'alimentation a fait l'objet d'une méta-étude qui conclut à l'absence de danger ou d'effet particulier pour la santé humaine ou animale[153]. Parallèlement certains experts se présentant comme indépendants et intervenant dans le débat public en faveur des OGM sont financés par des entreprises de l’industrie agroalimentaire, comme Monsanto[154].
En 2015 une équipe polonaise a publié une étude sur dix générations de cailles montrant l'absence de différence sur la croissance, la survie, l'état physiologique, la reproduction et la croissance de cailles nourries avec du maïs ou du soja OGM[155].
Opposition |
 Lire le média
Lire le médiaManifestation contre les OGM et Monsanto à Paris le 23 mai 2015.
L'introduction de la biotechnologie représentée par les OGM a rencontré des résistances et des oppositions qui n'ont pas cessé d'alimenter le débat public à partir de la fin des années 1990[156]. En France, une large partie de la population est favorable à l'interdiction des OGM[157],[158]. Échaudés par des crises sanitaires comme celle de la vache folle, les pouvoirs publics ont, au moins en Europe, cherché à répondre aux inquiétudes exprimées par leurs opinions publiques en proposant moratoires et réglementations censées permettre l'isolation des cultures traditionnelles et des cultures OGM. Cependant, considérant que la dissémination des graines est probable et cause un risque[159], les mouvements anti-OGM continuent en conséquence leur lutte, incarnée et symbolisée en France par le mouvement des « faucheurs volontaires ».
Risques environnementaux |
La principale critique est l'usage plus intensif des herbicides totaux notamment du glyphosate dont l'usage a fortement augmenté[160] depuis l'introduction des OGM : 80 % des plantes OGM y sont résistantes[161]. Une autre critique est l'incitation à la monoculture, mais ce point est en réalité peu documenté. D'une façon générale, il est difficile de juger l'effet du caractère transgénique face à des agrosystèmes gérés de façon différente[162]: la conduite de la culture et la rotation sont plus impactantes que le facteur OGM.
Du fait de l'utilisation de ces herbicides à grande échelle, la culture d'OGM est à l'origine d'une importante perte de biodiversité végétale dans les champs et autour de ceux-ci.[réf. nécessaire]D'autre part, la culture d'OGM implique une perte de diversité génétique des plantes cultivées elles-mêmes, celles-ci étant des clones. Cette diversité génétique quasiment nulle au sein d'un champ d'OGM rend ceux-ci vulnérables aux insectes ravageurs, qui développent des résistances à l'insecticide que l'OGM sécrète (dans le cas des plantes qui en sécrètent, comme le mais Bt).[réf. nécessaire]
Arguments favorables |
Les OGM présentent un avantage technique majeur en permettant de s'affranchir de la barrière des espèces, ils permettent de donner des caractères inédits aux organismes exploités par l'homme. Les OGM existants ont déjà permis :
- De doter des plantes d'une résistance intrinsèque contre les insectes ravageurs par l'expression d'une protéine BT ; ainsi, le coton Bt, cultivé à très grande échelle en Chine, a permis, d'une part, une diminution de l'utilisation d'insecticides chimiques à destination du coton, d'autre part, une augmentation des populations de coccinelles, araignées et chrysopes qui se nourrissent des insectes ravageurs des autres cultures, même non transgéniques, et donc les protègent[163].
- De faciliter le désherbage en permettant d'utiliser des produits à large spectre (glyphosate, glufosinate), tout en adoptant des techniques culturales simplifiées pour un coût moindre[164].
- Augmenter dans une certaine mesure la tolérance à la sécheresse[165]. DroughtGard, de Monsanto (en maïs), est actuellement la seule OGM présentant ce trait dit de tolérance à la sécheresse. Son efficacité est discutée[166],[167]. D'un autre côté, d'autres entreprises tablent sur des hybrides issus par sélection classique pour atteindre des résultats équivalents (notamment Pioneer avec son Optimum AquaMAX[166]).
- Le riz doré, destiné à la lutte contre les carences en vitamine A. La qualité nutritionnelle de ce riz est confirmée, mais il n'a pas encore reçu d'autorisation de mise sur le marché[168];
- De soutenir la culture de la papaye à Hawaï, menacée par un virus[169].
Le département de l'Agriculture des États-Unis (USDA) a publié en février 2014 une étude sur l'impact des OGM aux États-Unis au bout de quinze ans d'utilisation de ces semences introduites à partir de 1996, sur la base des 7 800 publications approuvées par l'USDA[170]. Les principales conclusions de ce rapport sont :
- trois cultures (maïs, coton et soja) forment l'essentiel des surfaces plantées en OGM : 169 millions d'acres (68,4 millions d'hectares) en 2013, soit environ la moitié des terres cultivées ; les cultures HT (tolérantes aux herbicides) représentent 93 % des surfaces plantées en soja, 85 % pour le maïs et 82 % pour le coton ; les cultures Bt (résistantes aux insectes) représentent 75 % des surfaces plantées en coton et 76 % pour le maïs ;
- les cultures Bt augmentent les rendements en réduisant les pertes dues aux insectes, surtout lorsque les semences combinent plusieurs modifications génétiques, ce qui est le cas pour 71 % des surfaces de maïs et 67 % pour celles de coton ;
- les agriculteurs utilisent moins d'insecticides lorsqu'ils plantent des semences Bt : l'utilisation d'insecticides a décliné de 0,21 livres (95 grammes) par acre en 1995 à 0,02 livres/acre en 2010, et la population de pyrale du maïs a fortement décru ; mais des indices de résistance des insectes apparaissent dans quelques régions ;
- les cultures HT ont permis de remplacer par du glyphosate des herbicides plus toxiques et persistants utilisés auparavant ; mais des résistances au glyphosate sont apparues chez 25 espèces de mauvaises herbes (notamment l'amaranthe de Palmer[171]), conduisant même au désherbage manuel dans certains États (Le Figaro titrait ainsi, en 2012 : « Les OGM ont perdu la guerre contre les mauvaises herbes »[172]) ;
- les prix des semences OGM de soja et de maïs ont augmenté d'environ 50 % en termes réels (ajustés pour l'inflation) de 2001 à 2010, et ceux du coton ont progressé encore plus vite, mais les gains de rendement se sont accrus grâce à l'introduction de nouvelles modifications génétiques, si bien que l'utilisation de ces semences continue à être plus profitable que celle des semences conventionnelles.
Éthique |
Sur le plan éthique, le développement des OGM entre dans le cadre de la controverse autour de la brevetabilité du vivant. Le dépôt de brevets par les grands groupes industriels du secteur qui leur confère des droits exclusifs sur une partie du patrimoine génétique est très critiqué, au-delà des cercles anti-OGM[réf. nécessaire]. Les opposants aux OGM redoutent une mainmise de plus en plus grande de l'industrie agro-alimentaire sur le bien commun universel que représentent pour l'agriculture les espèces naturelles[173].
De façon plus générale, la culture d'OGM, très souvent associée à l'usage massif d'herbicide total (Roundup en particulier) voire à la monoculture intensive, est critiquée par les opposants au motif qu'elle n'est que la continuation d'une agriculture productiviste, peu adaptée au réchauffement climatique et de façon globale au développement durable[réf. nécessaire].
Économie |
Sur le plan économique, le Service international pour l'acquisition d'applications agricoles biotechnologiques (ISAAA), organisation spécialisée dans le développement des OGM dans les pays en voie de développement, estime que la richesse créée en 2005 par les OGM pour les agriculteurs est un gain d'environ 4 % pour des agriculteurs modernes, pour des agriculteurs pauvres les gains apportés par les OGM BT seraient plus important, de l'ordre de 50 à 100 dollars par hectare, et ils éviteraient aussi beaucoup de travail d'épandage d'insecticide, très risqué pour les agriculteurs[174]. Bien sûr, la nature même de l'ISAAA ne la pousse guère à l'impartialité.
Les opposants dénoncent certaines conséquences économiques de la mise en place massive des OGM, comme une plus grande dépendance des agriculteurs aux semenciers[note 4] car les paysans ne pouvant resemer les grains de leur récolte, ils sont tenus de racheter des semences tous les ans à ces mêmes industriels. Les critiques se portent également sur le fait que la mise en place des OGM dans de nombreuses régions pauvres (Afrique, Asie) a conduit à la disparition progressive des petits producteurs, ce qui a entraîné l'accaparement de leurs terres par de grosses exploitations, et la migration de ces petits paysans « dans de misérables implantations urbaines »[175].
Pour les partisans d'une agriculture paysanne, tels les agriculteurs rassemblés dans Via Campesina, et dans le contexte d'une promotion de l'agriculture biologique, la culture des OGM apparait comme le dernier atout d'une agriculture industrielle. Ils voient dans le développement des OGM le renforcement de l'emprise de l'industrie agroalimentaire, matérialisé par les grands groupes industriels (les groupes américains Monsanto et Pioneer Hi-Bred, allemands BASF et Bayer CropScience ou suisse Syngenta), sur l'agriculture mondiale qui, selon eux, s'oppose en partie au développement de la souveraineté alimentaire dans les pays dont la production agricole est principalement destinée à l'exportation[176].
Par ailleurs, de nombreux pays d'Afrique (parmi les exceptions figurent l'Afrique du Sud, l'Égypte et le Burkina Faso, pays producteurs d'OGM[177]) ont eux-mêmes vivement dénoncé dans un communiqué en juin 1998 l'utilisation qui était faite, par la firme Monsanto, de leur image et de la pauvreté afin de contribuer à promouvoir les OGM dans les pays industrialisés. Ils dénonçaient alors notamment que « les images de pauvreté et de faim dans nos pays soient utilisés par des multinationales afin de promouvoir une technologie qui n'est ni saine, ni respectueuse de l'environnement et ne nous bénéficie en rien »[178]. Ces groupes industriels soumis à la pression des marchés seraient suspectés de faire passer la rentabilité économique avant l'intérêt des populations.
La cohabitation de cultures OGM avec l'apiculture pose un problème juridique faisant débat, illustré par deux décisions contradictoires de la Cour de justice de l'Union européenne (CJUE) en 2012. D'une part, la levée de l'interdiction de culture de maïs MON 810 en France, en place depuis 2008 et l'activation de la « clause de sauvegarde » par le gouvernement français à la suite de la requête des apiculteurs français - la Cour a jugé que l'invocation de la clause de sauvegarde pour interdire la culture du maïs MON 810 par la France n'avait pas de base légale[179], mais n'a pas porté de jugement sur la justesse de l'invocation de la clause - ; et d'autre part, la confirmation que « Du miel contenant du pollen issu d'un OGM ne peut être commercialisé sans autorisation préalable »[180] à la demande d'un apiculteur allemand[181],[note 5]. Dans cette affaire, le Parlement européen a récemment précisé la réglementation et donc infirmé le jugement de la CJUE, par la Directive 2014/63 qui précise que "Le pollen, en tant que constituant naturel propre au miel, n'est pas considéré comme un ingrédient"[182].
Recherche et conflits d'intérêts |
Une étude réalisée en 2016 par l'Institut national de la recherche agronomique montre qu'une proportion significative des recherches scientifiques menées sur les OGM est entachée de conflits d'intérêts. En analysant un corpus de 672 articles scientifiques consacrés aux OGM, publiés entre 1991 et 2015, l'INRA parvient à deux conclusions : d'une part, 40 % de ces articles témoignent de conflits d'intérêts, et d'autre part ces conflits d'intérêts ont une influence majeure sur le résultat des publications, puisque « quand conflit d’intérêts il y a, les conclusions ont 49 % de chances d’être plus favorables aux intérêts des industries semencières »[183]. Les chercheurs de l'INRA ont pris conscience de ces conflits d'intérêts en relevant simplement les déclarations des auteurs de publication, qui indiquaient des liens avec les industriels Monsanto, Bayer, Syngenta, Dow AgroSciences et DuPont Pioneer. Cependant, ce conflit d'intérêt connu « ne représente que le sommet de l’iceberg. Car seuls 7 % des articles contenaient une déclaration d’intérêts des auteurs. Quid des autres ? Par ailleurs, certains liens avec les industriels, susceptibles d’avoir un impact notable, sont rarement déclarés et n’ont pas pu être pris en compte, comme le fait d’être membre du conseil scientifique d’une firme, consultant ou détenteur de brevets »[183].
À noter, que cette étude a été critiquée[Par qui ?] autant sur les critères de sélection des 672 articles, sur sa pertinence statistique ainsi que sur les conclusions apportées par les auteurs[184].
Notes et références |
Notes |
rBGH pourrecombinant Growth Hormone Bovine, ou rBST pour recombinant Bovine Somatotropin (terme utilisé par l'entreprise Monsanto)
L'OMS écrit que « on n’a jamais pu montrer que leur consommation par le grand public dans les pays où ils ont été homologués ait eu un quelconque effet sur la santé humaine » ; OMS, réponses à questions sur les OGM, Q8. Consulté le 12 mai 2008
Le potentiel réside dans la possibilité théorique de modifier un caractère par caractère, au niveau du gène, alors que les méthodes traditionnelles d'amélioration des organismes reposent sur la sélection des caractères visibles, sans contrôle au niveau du gène concerné, et des gènes voisins
Par la production de graines stériles, comme en mettant en place le gène Terminator dans les semences.
Le maïs MON 810 est autorisé à la culture dans l'Union européenne, les ingrédients alimentaires dérivés du MON 810 sont autorisés à la consommation humaine mais pas le pollen de MON 810, dont la procédure d'autorisation est en cours. Cependant la plupart des professionnels du secteur estiment que la CJUE s'est trompée en estimant que le pollen était un ingrédient du miel au sens de la Directive 2000/13, un règlement corrigeant ce point a été publié en septembre 2012. D'autre part, l'EFSA a estimé en décembre 2012 que le pollen de MON 810 ne posait aucun danger pour la santé humaine.
Références |
Glossaire de l'INRA
Site interministériel sur les OGM
Directive 2001/18/CE du Parlement européen et du Conseil du 12 mars 2001
Genetically Engineered Foods, James H. Maryanski, FDA, octobre 1999
USDA:glossaire des biotechnologie
Gilles-Eric Séralini, Ces OGM qui changent le monde, Champs Flammarion, p. 9.
Jean-Paul Renard, « Texte de la 28ème conférence de l'Université de tous les savoirs, Le clonage »(Archive • Wikiwix • Archive.is • Google • Que faire ?), sur Centre Informatique National de l’Enseignement Supérieur, janvier 2000(consulté le 23 avril 2009)
site de la Commission de l’éthique, de la science et de la technologie (Québec) : « introduction »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013) ; liste bibliographique
données ISAAA 2011
(en) John Vidal, « Campaigners clash over industry claims of rise in GM crops », The Guardian, 8 février 2012(lire en ligne).
(en) Daniel G. Gibson, John I. Glass, Carole Lartigue, Vladimir N. Noskov, Ray-Yuan Chuang,Mikkel A. Algire, Gwynedd A. Benders,2 Michael G. Montague, Li Ma, Monzia M. Moodie,Chuck Merryman, Sanjay Vashee, Radha Krishnakumar, Nacyra Assad-Garcia,Cynthia Andrews-Pfannkoch, Evgeniya A. Denisova, Lei Young, Zhi-Qing Qi,Thomas H. Segall-Shapiro, Christopher H. Calvey, Prashanth P. Parmar, Clyde A. Hutchison, III, Hamilton O. Smith, J. Craig Venter, « Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome », Science, 20 mai 2010(DOI 10.1126/science.1190719, lire en ligne)
Cécile Klingler, « Vers les premières bactéries synthétiques », sur La Recherche.fr, mai 2010(consulté le 21 mai 2010).
« An overview of the last 10 years of genetically engineered crop safety research ».Genetically Engineered Crops.
The Independent Science Panel on GM Final Report
Didier Raoult, « Les Nobel contre Greenpeace », Le Point, 9 juillet 2016(lire en ligne)
Stéphane Foucart, « Greenpeace est-elle vraiment coupable de « crime contre l’humanité » ? », Le Monde, 4 juillet 2016(lire en ligne)
C'est la définition du département de l'Agriculture des États-Unis
Article 3 du protocole de Cartagène
Simonetta Zarrilli, International Trade in GMOs and GM Products : National and Multilateral Legal Frameworks, Policy Issues in International Trade and Commodities, Study Series n° 29, ONU, p. 25
« Directive sur la dissémination volontaire d'OGM », sur EUR-Lex, Partie A, article 2
glossaire des termes statistiques de l'OCDE
(en) « Glossary of Agricultural Biotechnology Terms », sur United States Department of Agriculture (consulté le 10 novembre 2008)
Gouvernement du Québec, Étiquetage aux États-Unis
Explications reprises dans la directive communautaire 2001/18/CE, « Directive sur la dissémination volontaire d'OGM », sur EUR-Lex
Glossaire de l'OCDE
Food Ingredients and Packaging Terms
Agence canadienne d’inspection des aliments
Loi sur le génie génétique, LGG
Encarta francophone
Encarta anglophone
20 questions sur les aliments transgéniques, Publication de l'OMS
Document de l'UNCTAD
Natural Environment Research Council
Department for Environment, Food and Rural Affairs, Gouvernement du Royaume-Uni
Dictionnaire de la cité des sciences
« OGM, les Organismes Génétiquement modifiés », Greenpeace
Limagrain. Document « à propos » : les OGM, daté du 16 février 2007.
ISAAA, Publication pédagogique destinée aux journalistes, page 25
Souris génétiquement modifiées, site BioPortail du Gouvernement canadien. Consulté le 21 avril 2008.
Espèces modèles végétales à l'INRA
les espèces modèles en général
Biotechnologies : les médicaments OGM débarquent !, 21 juin 2007, Biomagazine cité des sciences
[PDF]Rapport 2006 de l'ISAAA
« Qui tire profit des cultures OGM ? », 9 janvier 2007(consulté le 11 avril 2013), rapport de Les Amis de la Terre.
Pas d'application en janvier 2006, cf. «Un survol des techniques et des applications actuelles de la transgénèse animale », Louis-Marie Houdebine, article dans L'Observatoire de la génétique, janvier 2006.
Christophe Noisette, « Les animaux génétiquement modifiés : pas vraiment au point », Inf'OGM 146, juillet / août 2017 (lire en ligne)
Pour une gestion éthique des OGM, Commission de l’éthique de la science et de la technologie du Québec, page 88
« Sélection naturelle, sélection variétale et OGM : Éloge d'une bâtardise vieille comme le monde J.M. Bonneville, Chercheur au CNRS Université Joseph Fourier de Grenoble »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
(en) Ochiai, K., Yamanaka, T Kimura K and Sawada, O, « Inheritance of drug resistance (and its tranfer) between Shigella strains and Between Shigella and E.coli strains », Hihon Iji Shimpor, vol. 1861, 1959, p. 34
(en) Akiba T, Koyama K, Ishiki Y, Kimura S, Fukushima T., « On the mechanism of the development of multiple-drug-resistant clones of Shigella », Jpn J Microbiol., vol. 4, 1960 apr, p. 219-27 (PMID 13681921)
(en) Richardson, A. O. and J. D. Palmer, « Horizontal gene transfer in plants », J. Exp. Bot., vol. 58, no 1, 2007), p. 1-9 (PMID 17030541, lire en ligne)
(en) Keeling, P. J. and J. D. Palmer, « Horizontal gene transfer in eukaryotic evolution », Nat Rev Genet, vol. 9, no 8, 2008, p. 605-618 (PMID 18591983, lire en ligne)
Jared Diamond, De l'inégalité parmi les sociétés [« Guns, Germs and Steel »], Gallimard, coll. « NRF Essais », 22 novembre 2000, 484 p. (ISBN 2070753514), chapitre 8
Histoire et Amélioration de cinquante plantes cultivées, C. Doré et F. Varoquaux, INRA éditions.
« Du Téosinte au Maïs transgénique »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013).
par exemple :Hybridation naturelle entre deux sous-espèces de souris domestiques, Mus musculus domesticus et Mus musculus castaneus, près du lac Casitas (Californie), NRC Canada, 1998
Ariane, 60 années d'effort pour la mise en orbite … d'une pomme, site de l’INRA, janvier 2003
« CIRAD Dossier OGM »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
Encyclopédie Universalis, v. 11, 2005, article Organismes génétiquement modifiés - repères chronologiques
(en) David A. Jackson, Robert H. Symons and Paul Berg, « Biochemical Method for Inserting New Genetic Information into DNA of Simian Virus 40: Circular SV40 DNA Molecules Containing Lambda Phage Genes and the Galactose Operon of Escherichia coli », PNAS, vol. 69, no 10, 1972, p. 2904-2909 (ISSN 0027-8424, lire en ligne)
(en) Discours de Paul Berg, devant l'académie des prix Nobel, pages 391-393
Historique des OGM, site d'information sur les OGM du Québec
Albert Hinnen, James H. Hicks et Gerald R. Fink, « Transformation of yeast », PNAS, 1978, p. 1929-1933 (lire en ligne)
(en) Marx JL, « Building bigger mice through gene transfer », Science, vol. 218, no 4579, 24 décembre 1982, p. 1298 (PMID 7146912)
(en) Horsch, R. B.; Fry, J. E.; Hoffmann, N. L.; Eichholtz, D.; Rogers, S. G.; Fraley, R. T., « A Simple and General Method for Transferring Genes into Plants », Science, vol. 227, no 4691, 8 mars 1985, p. 1229-1231 (DOI 10.1126/science.277.4691.1229)
Hervé Morin, « Création d'une cellule « synthétique » », sur Le Monde.fr, mai 2010
Le Monde selon Monsanto, Marie Monique Robin, p. 148.
« Site de la Commission de l'éthique de la technologie et de la science du Québec, consulté le 18 mars 2008 »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
http://www-personal.umich.edu/~spwright/ Susan Wright
Molecular Politics
Developing American and British Regulatory Policy for Genetic Engineering, 1972-1982 Susan Wright The University of Chicago Press 1994
Breveter le vivant, site de radio-canada
L'hormone de croissance recombinante : intérêt et risques potentiels de son utilisation pour la production laitière bovine, INRA, 1998
GREENPEACE Les consommateurs forcent Monsanto à abandonner l’hormone génétiquement modifiée du lait
Transgéniques : pour des choix responsables, Rapport du France de 1998
INFOGM OGM aux États-Unis : quand l’administration ignore ses experts Le cas de la tomate FLAVR / SAVR
« Monsanto US products »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
(fr) portail du Protocole
liste des signataires
France : la lutte contre les OGM - Attac France
Module de formation concernant l'accord SPS, chapitre 8, OGM, site de l’OMC. Consulté le 23 janvier 2008
Index des questions faisant l’objet d’un différend, site de l'OMC
« OGM : une affaire européenne », Marc Clément (magistrat administratif), Telos, 1er février 2008
Ethirajan Anbarasan, « Terminator chez les semences », sur http://www.unesco.org/, Le Courrier de l'UNESCO, 1999(consulté le 3 décembre 2008)
« site interministériel sur les OGM, Qu'est-ce qu'un organismes génétiquement modifiés (OGM) ? »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013) (France). Consulté le 8 mai 2008
exemple d'invalidation d'un gène, site internet de l’université Pierre-et-Marie-Curie
site pédagogique de l'université de Jussieu
« Génome des plantes Les précieux secrets d'une mauvaise herbe »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013), CNRS juin 2005
(en) Animations résumant les méthodes et les étapes du séquençage du génome humain
les OGM à L'INRA
« Site interministériel sur les OGM (France) Le marquage par gènes de résistance aux antibiotiques »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
Gouvernement du Québec Source d'information sur les organismes génétiquement modifiés Glossaire
(en) Al-Babili, Salim
Beyer, Peter, « Golden Rice - five years on the road - five years to go? », Trends in Plant Science, vol. 10, no 12, 2005, p. 565-573 (lire en ligne)
Gouvernement du Québec Source d'information sur les organismes génétiquement modifiés Utilisation potentielles des animaux gm Moléculture animale
« site interministériel sur les ogm »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
source :FAO
http://www.gmo-compass.org/eng/gmo/db/
http://www.gmo-compass.org/eng/grocery_shopping/fruit_vegetables/
OGM : Utilisation actuelle : Tolérance aux herbicides, site du gouvernement du Québec
(en) Australia continues to test drought-resistant GM wheat
(en) « Scientist develops corn that can weather drought »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013)
(en) Zhang, Qifa, « Strategies for developing Green Super Rice », Proceedings of the National Academy of Sciences, vol. 104, no 42, 16 octobre 16 2007, p. 16402-16409 (DOI 10.1073/pnas.0708013104, lire en ligne)
(en) Jon Lyall et coll., « Suppression of Avian Influenza Transmission in Genetically Modified Chickens », Science, vol. 331, no 6014, 14 janvier 2011, p. 223-226 (DOI 10.1126/science.1198020)
Un peuplier OGM dans le moteur ?, Mission Agrobiosciences, septembre 2006
Le peuplier OGM cherche son débouché, Les Échos, 24 janvier 2008
(en) « Europa Questions et réponses sur les OGM » : « The complementary authorisation is taken under Regulation (EC) No 1829/2003 on GM food and feed. It covers the by-products of the starch extraction when they are used as feed. It also covers the unintended presence of GM potato tubers in food and feed. While all measures are in place to prevent that the starch potato is mixed with potato for food and feed, it can never be totally excluded. This is why this unintended
presence has also been thoroughly assessed by EFSA and covered by an authorisation up to a level of 0.9% » (version en français)
(en) DownstreamToday.com – 7 octobre 2010 « French Firm Prototypes Process for Producing Isobutene from Glucose. »
directive 2001/18/CE sur europa, site officiel de l'Union
Questions et réponses sur la réglementation des OGM dans l'Union européenne Europa
[PDF] Journal officiel de l'Union européenne
[PDF] 1829/2003/CE Journal officiel de l'Union européenne
Site officiel de l'AFSSA
« Présentation de la Commission du Génie Biomoléculaire »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 11 avril 2013) Site du Gouvernement français
EFSA site de l'UE
[PDF]L'EFSA et les OGM L'EFSA fournit une base scientifique aux décisions de UE sur les OGM, mais elle ne participe pas au processus de décision
inf'OGM Quels sont les OGM autorisés dans l’Union européenne ?
(en) Friends of the Earth Europe Un regard sur l'EFSA et son travail sur la nourriture et les plantes génétiquement modifiées
« OGM : réformons l'autorité européenne de la sécurité alimentaire », Rue89, 2 juillet 2009.
http://sante.lefigaro.fr/actualite/2012/11/14/19434-pas-risque-sanitaire-avec-ogm-autorises-europe
Herouet C., Evaluation de l'innocuité des plantes issues de l'agribiotechnologie, Toxinogenèse - biosynthèse, ingénierie, polymorphisme, neutralisation des toxines. Goudey-Perrière F., Bon C., Ménez A., Puiseux-Dao S, Eds. Elsevier SAS, 181-190, 2003
Hérouet, C., Esdaile, D.J., Mallyon, B.A., Debruyne, E., Schulz, A., Currier, T.,Hendrickx, K., van der Klis, R. and Rouan, D. 2005. Safety evaluation of the phosphinothricin acetyltransferase proteins encoded by the pat and bar sequences that confer tolerance to glufosinate-ammonium herbicide in transgenic plants. Regulatory Toxicology and Pharmacology 41: 134-149
Herouet-Guicheney, C., Rouquié, D., Freyssinet, M., Currier, T., Martone, A., Zhou, J., Bates, E. E. M., Ferullo, J.-M., Hendrickx, K., Rouan, D. 2009. Safety evaluation of the double mutant 5-enol pyruvylshikimate-3-phosphate synthase (2mEPSPS) from maize that confers tolerance to glyphosate herbicide in transgenic plants. Regulatory Toxicology and Pharmacology 54 : 143-153
How Subchronic and Chronic Health Effects can be Neglected for GMOs, Pesticides or Chemicals International Journal of Biological Sciences
Réponse de l'Autorité européenne de sécurité des aliments aux critiques de Séralini [lire en ligne]
OMG poisons : la vraie fin de l'affaire Séralini
« OGM : une affaire européenne », Marc Clément (Magistrat administratif), Telos, 1er février 2008
Global Status of Commercialized Biotech/GM Crops: 2017
(en)données ISAAA 2013
« https://www.infogm.org/6366-2017-europe-baisse-culture-ogm-transgenique », sur infogm.org (consulté le 8 décembre 2017)
Commissariat général au développement durable - Direction de la recherche et de l’innovation - Service de la recherche, « Programme National de Recherche « Risques environnementaux et sanitaires liés aux OGM » consulté le=24 janvier 2016 », sur www.developpement-durable.gouv.fr, juillet 2013.
« Long-term effects unknown for GM foods, as well as most foods. Difficult to detect long-term effects due to many confounding factors and genetci variabylity in foods and related effects in the population » p. 23 (en) ICSU (2003), présentation du Rapport de l'ISCU
http://blogs.mediapart.fr/blog/yann-kindo/250313/le-militantisme-anti-ogm-ou-l-anticapitalisme-au-service-de-carrefour-et-auchan
http://tempsreel.nouvelobs.com/ogm-le-scandale/20120918.OBS2789/ogm-quand-la-grande-distribution-finance-une-etude-choc.html
(en) Gilles-Eric Séralini, Emilie Clair, Robin Mesnage, Steeve Gress, Nicolas Defarge, Manuela Malatesta, Didier Hennequin et Joël Spiroux de Vendômois, « Long term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize », Food and Chemical Toxicology, vol. 50, 2012, p. 4221–4231 (lire en ligne)« The significant biochemical disturbances and physiological failures documented in this work confirm the pathological effects of these GMO and R treatments in both sexes, with different amplitudes. »
Guillaume Malaurie, « EXCLUSIF. Oui, les OGM sont des poisons ! », Le nouvel Observateur, 20 septembre 2012
MISSION AGROBIOSCIENCES, « AU-DELÀ DU BUZZ... », septembre 2012
(en) Andrew Pollack, « Foes of Modified Corn Find Support in a Study », New York Times, 19 septembre 2012(lire en ligne)
(en) Declan Butler, « Rat study sparks GM furore », Nature, 25 septembre 2012(lire en ligne)
« Avis des Académies nationales d’Agriculture, de Médecine, de Pharmacie, des Sciences, des Technologies, et Vétérinaire sur la publication récente de G.E. Séralini et al. sur la toxicité d’un OGM », sur Institut de France, 19 octobre 2012(consulté le 12 décembre 2012)
« Avis en réponse à la saisine du 24 septembre 2012 relative à l’article de Séralini et al. (Food and Chemical Toxicology, 2012). », sur Haut Conseil des biotechnologies, 19 octobre 2012(consulté le 18 décembre 2012)
(en) « Advice of the Belgian Biosafety Advisory Council on the article by Seralini et al., 2012 on toxicity of GM maize NK603 », sur Conseil de Biosécurité, 19 octobre 2012(consulté le 11 décembre 2012)
(en) « Feeding study in rats with genetically modified NK603 maize and with a gly-phosate containing formulation (Roundup) published by Séralini et al. (2012) », sur Bundesinstitut für Risikobewertung, 1er octobre 2012(consulté le 11 décembre 2012)
(da) « DTU Fødevareinstituttets vurdering af nyt langtidsstudie med gensplejset majs NK603 og med sprøjtemidlet Roundup », sur DTU Fødevareinstituttet, octobre 2012(consulté le 11 décembre 2012)
« Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif à l'analyse de l’étude de Séralini et al. (2012) « Long term toxicity of a ROUNDUP herbicide and a ROUNDUP-tolerant genetically modified maize » », sur ANSES, 19 octobre 2012(consulté le 11 décembre 2012)
(nl) « Genetisch gemodificeerde maïs (NK 603) en herbicide Roundup », sur Nederlandse Voedsel-en Warenautoriteit, 3 octobre 2012(consulté le 11 décembre 2012)
(en) « Final review of the Séralini et al. (2012a) publication on a 2-year rodent feeding study with glyphosate formulations and GM maize NK603 as published online on 19 September 2012 in Food and Chemical Toxicology », sur EFSA, novembre 2012(consulté le 11 décembre 2012)« Considering that the study as reported in the Séralini et al. publications is inadequately designed, analysed and reported and taking into consideration MS assessments, EFSA finds that it is of insufficient scientific quality for safety assessments. Therefore, EFSA concludes that the Séralini et al. study as reported in their publications does not impact the ongoing re-evaluation of glyphosate. Based on the currently available evidence EFSA does not see a need to reopen the existing safety evaluation of maize NK603 and its related stacks. »
http://sciences.blogs.liberation.fr/home/2013/12/ogm-larticle-de-g-e-s%C3%A9ralini-r%C3%A9tract%C3%A9.html
Commissariat général au développement durable, Programme National de Recherche « Risques environnementaux et sanitaires liés aux OGM » (Risk’OGM). Appel à la constitution d’un consortium de recherche pour l’étude des effets sanitaires à long terme liés à la consommation d’OGM de recherche sur les effets des OGM, 2013, [1]
European Food Safety Authority, « Considerations on the applicability of OECD TG 453 to whole food/feed testing », EFSA Journal, 2013;11(7):3347 [18 pp.]. DOI:10.2903/j.efsa.2013.3347
(en) Kevin P. Keenan, Gordon C. Ballam, Rakesh Dixit, Keith A. Soper, Philippe Laroque, Britta A. Mattson, Stephen P. Adams et John B. Coleman, « The effects of diet, overfeeding and moderate dietary restriction on Sprague-Dawley rat survival, disease and toxicology », The Journal of Nutrition, vol. 127, no 5, mai 1997, p. 851S–856S (PMID 9164252, lire en ligne).
(en) Motokuni Nakazawa, Takeharu Tawaratani, Hiroshi Uchimoto, Akitaka Kawaminami, Makoto Ueda, Akiko Ueda, Yasuhiko Shinoda, Keiko Iwakura, Kohei Kura et Nobuyoshi Sumi, « Spontaneous neoplastic lesions in aged Sprague-Dawley rats », Experimental Animals, vol. 50, no 2, avril 2001, p. 99–103 (PMID 11381627, DOI 10.1538/expanim.50.99).
(en) H. Suzuki, U. Mohr et G. Kimmerle, « Spontaneous endocrine tumors in Sprague-Dawley rats », Journal of Cancer Research and Clinical Oncology, vol. 95, no 2, octobre 1979, p. 187–196 (PMID 521452, DOI 10.1007/BF00401012).
http://www.sciencedirect.com/science/article/pii/S0278691513007102
http://gmopundit.blogspot.fr/2007/06/150-published-safety-assessments-on-gm.html
Stéphane Foucart, « Dis-moi qui te paie… », sur Le Monde.fr, 14 septembre 2015(ISSN 1950-6244, consulté le 22 janvier 2016).
(en) K. E. Sartowska, A. Korwin-Kossakowska et G. Sender, « Genetically modified crops in a 10-generation feeding trial on Japanese quails — Evaluation of its influence on birds’ performance and body composition », Poultry Science, 15 octobre 2015, pev271 (ISSN 0032-5791 et 1525-3171, PMID 26475068, DOI 10.1093/ps/pev271, lire en ligne, consulté le 20 octobre 2015)
Les OGM à l'INRA Risques et acceptabilité des biotechnologies : l'affaire d'un malentendu ? par Pierre-Benoît Joly, Unité d'Économie et Sociologie rurales, INRA Grenoble
« 86 % des Français réclament une interdiction des OGM », sur www.greenpeace.org, janvier 2006
liste des sondages français, européens et internationaux sur la question des ogm
(en) D. Quist et I.H. Chapela, « « Transgenic DNA introgressed into traditional maize landraces in Oaxaca, Mexico » », Nature, vol. 414, 2001, p. 541-3 (lire en ligne)
http://www.enveurope.com/content/24/1/24
http://www.agbioforum.org/v12n34/v12n34a10-duke.htm
http://www.nature.com/news/2004/041129/full/news041129-2.html
Le coton Bt transgénique serait écologique en Chine, site Sciences-blog de Sylvestre Huet, journaliste scientifique de Libération, consulté le 2 juin 2014.
Assessing the economic and ecological impacts of herbicide tolerant canola in Western Canada, 2010
Monsanto’s GM Drought Tolerant Corn
Farmers test drought-tolerant corn hybrids, Corn + Soybean Digest, 23 janvier 2015
Monsanto’s “DroughtGard” Corn Barely a Drop in the Bucket, Union of Concerned Scientists, 5 juin 2012
http://www.goldenrice.org/PDFs/GR_bioavailability_AJCN2012.pdf
(en) « Les OGM peuvent être une solution » : « la culture de la papaye à Hawaï a failli complètement disparaître au début des années 1990 à la suite de l’apparition d’un virus extrêmement agressif. A la même époque, un chercheur de l’USDA avait développé des plantes résistantes au virus et les testait en champ sur l’île d’Hawaï. Ces plantes transgéniques furent rapidement acceptées et plantées par les cultivateurs et permirent d’éviter un désastre »
(en)Genetically Engineered Crops in the United States - Report summary, département de l'Agriculture des États-Unis, février 2014.
Natasha Gilbert, "Case studies: A hard look at GM crops", Nature, 1er mai 2013
Les OGM ont perdu la guerre contre les mauvaises herbes, Le Figaro, 25 mai 2012
Marcelo D. Varella, « Point de vue propriété intellectuelle et semences : les moyens du contrôle des exportations agricoles par les entreprises multinationales », Revue internationale de droit économique, t. XX, 2 2006/2, p. 211 à 228. [lire en ligne]
[PDF] (en) Rapport 2006 de l'ISAAA, rétrospective sur 10 ans, pages viii, xv, 36, 40
Voir l'encyclique Laudato si’, § 132-134. François, Loué sois-tu. Laudato si' : Encyclique, Cerf, coll. « Docs Eglises », juin 2015, 120 p. (ISBN 978-2204102872, lire en ligne).
« Nous les paysans et paysannes sommes la solution à la faim dans le monde » (consulté le 11 avril 2013), Via Campesina, 28 mai 2008.
Rapport de l'ISAAA sur l'état mondial des plantes GM en 2009. [lire en ligne]
« Let's nature harvest continue! », réponse de certains délégués africains aux négociations organisées par la FAO sur l'« International Undertaking for Plant Genetic Resources », juin 1998. [lire en ligne]
Décision de la Cour de justice européenne sur le MON810
Communiqué de Presse de la Cour de Justice de l'Union européenne sur le miel contenant du pollen de MON 810
« L'OGM qui menace la production de miel », Sud Ouest, 14 janvier 2012(lire en ligne)
.Directive 2014/63
Stéphane Horel, « La recherche sur les OGM est minée par les conflits d’intérêts », Le Monde, 19 décembre 2016(lire en ligne).
« Maïs Bt et conflits d’intérêt : de la science à la propagande », sur www.forumphyto.fr, 20 janvier 2017
Annexes |
.mw-parser-output .autres-projets ul{margin:0;padding:0}.mw-parser-output .autres-projets li{list-style-type:none;list-style-image:none;margin:0.2em 0;text-indent:0;padding-left:24px;min-height:20px;text-align:left}.mw-parser-output .autres-projets .titre{text-align:center;margin:0.2em 0}.mw-parser-output .autres-projets li a{font-style:italic}
Bibliographie |
Ouvrages de références |
- Dominique de Vienne, Les marqueurs moléculaires en génétique et biotechnologies, INRA éditions, 1998.
- Sandy Primrose, Richard Twyman, R. W. Old, Bob Old, Lionel Domenjoud, Principes de génie génétique, De Boeck Université, 2004.
Essais |
Berthier Sylvie et Pean Valérie, Les OGM à l'épreuve des arguments, éditions Quae, 2011 (ISBN 978-2-7592-1651-2).
Berlan, Jean-Pierre, (Sous la direction de) La guerre au vivant, OGM et mystifications scientifiques, Agone éditeur, 2001.- Herouet C., Evaluation de l'innocuité des plantes issues de l'agribiotechnologie, Toxinogenèse - biosynthèse, ingénierie, polymorphisme, neutralisation des toxines. Goudey-Perrière F., Bon C., Ménez A., Puiseux-Dao S, Eds. Elsevier SAS, 181-190, 2003.
Houdebine, Louis-Marie, OGM : Le vrai et le faux, Éditions Le Pommier, 2003, (ISBN 2746501228).- Jean-Claude Jaillette (préf. Axel Kahn), Sauvez les OGM, Hachette Littérature, coll. « Essais Et Document », 19 mai 2009, 252 p. (ISBN 978-2-01-237640-3, présentation en ligne)
- Joly P.-B. (sous la direction de), L'Innovation controversée : le débat public sur les OGM en France, INRA Grenoble, 2000.
- Kafadaroff G., OGM : le gâchis. Dix années de turpitudes françaises, L'écritoire du publieur, 2005.
- Kahn, A. et Lecourt, D., Bioéthique et liberté, PUF/Quadrige essai, Paris, 2004.
Kempf, Hervé, La guerre secrète des OGM, Seuil, 2003.- Lemarchand F. La vie contaminée. Éléments pour une socio-anthropologie des sociétés épidémiques. L’Harmattan, 2002.
Paul Lannoye, Transgénique : le temps des manipulations (ouvrage collectif sous la direction de Paul Lannoye, Président du groupe des « verts » au parlement européen), Éditions Frison-Roche Paris, 1998.- Marris C, Wynne B., Simmons P., Weldon S. et al., Perceptions publiques des biotechnologies agricoles en Europe, 2002 [lire en ligne].
- Noisette, Christophe, Des OGM pour nourrir le monde ?, éd. Inf'OGM, 2009, 88 p., 110 g, 7 euros, https://www.infogm.org/brochure-des-OGM-pour-nourrir-le-monde
- Oury, Jean-Paul & Claude Debru, La Querelle des OGM, PUF, 2006, 303 p., (ISBN 2130555500).
- Ricroch, Agnès & André Gallais, Plantes transgéniques : faits et enjeux, éditions Quae, 2006, 334 p., (ISBN 2-7592-0001-9).
- Roy A., Les Experts face au risque : le cas des plantes transgéniques, PUF, 2001.
Séralini, Gilles-Eric, Génétiquement incorrect, Flammarion, 2003.
Seralini, Gilles-Eric, Ces OGM qui changent le monde, Flammarion, 2004, 228 p. (ISBN 2080800620) ; nouvelle édition revue et augmentée en 2010 (ISBN 9782081235007).
Jacques Testart et Yves Chupeau, OGM : quels risques ?, Prométhée, coll. « Pour ou contre ? », Bordeaux, 2007 (ISBN 978-2916623016).
Jacques Testart, À qui profitent les OGM ?, CNRS éditions, 2013 (ISBN 978-2-271-07669-4).
Article connexe |
- Certificat d'obtention végétale
Organisations non gouvernementales |
Service international pour l'acquisition d'applications agricoles biotechnologiques (ISAAA), qui actualise annuellement les statistiques sur l'utilisation d'OGM dans le monde, entre autres- Comité de recherche et d'information indépendantes sur le génie génétique (CRIIGEN)
- Association Inf'OGM : veille citoyenne pour une information critique et indépendante sur les OGM, France
- Association française des biotechnologies végétales
Liens externes |
Sites d'organisations gouvernementales |
Canada |
- Site officiel de l'Agence canadienne d'inspection des aliments sur les végétaux à caractères nouveaux
- Site officiel du Québec sur les OGM
France |
- Site interministériel sur les OGM
Organismes génétiquement modifiés à L'INRA : environnement, agriculture et alimentation, Institut national de la recherche agronomique (INRA), mai 1998- Site du Haut Conseil des biotechnologies
Suisse |
- Programme national de recherche (PNR) 59 « Utilité et risques de la dissémination des plantes génétiquement modifiées »
International |
Les biotechnologies dans l'alimentation et l'agriculture, regroupement des rapports de l'Organisation des Nations unies pour l'alimentation et l'agriculture sur les biotechnologies.
(en) Biotechnologies (aliments OGM), site de l'Organisation des Nations unies
Dossiers à vocation scientifique |
OGM : un tour d'horizon complet, Futura-Sciences, 3 avril 2008- Dossier de l'association française pour l'information scientifique sur les OGM
- Portail de la biologie cellulaire et moléculaire
- Portail de l’agriculture et l’agronomie
- Portail de la bioéthique