Eisen(III)-phosphat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
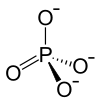 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisen(III)-phosphat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
Summenformel | FePO4 | |||||||||||||||
| Kurzbeschreibung | gelblichweißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
Molare Masse | 150,83 g·mol−1 | |||||||||||||||
Aggregatzustand | fest | |||||||||||||||
Dichte | 2,87 g·cm−3[2] | |||||||||||||||
Schmelzpunkt | 500 °C (Zersetzung zu Eisen(III)-oxid)[3] | |||||||||||||||
Löslichkeit | Schwer löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eisen(III)-phosphat ist eine chemische Verbindung aus der Gruppe der Phosphate, genauer der Eisenphosphate. Es kommt auch in mehreren hydratisierten Formen FePO4 · n H2O vor, wobei ab 140 °C das Kristallwasser abgegeben wird.[3]
Inhaltsverzeichnis
1 Vorkommen
2 Gewinnung und Darstellung
3 Verwendung
4 Verwandte Verbindungen
5 Einzelnachweise
Vorkommen |
Eisen(III)-phosphat kommt auch natürlich im Boden (z. B. als Mineral Strengit[4]) vor. Bei Einbringung von Phosphaten (aus Düngemitteln) in Wasser entsteht auch natürlich Eisen(III)-phosphat.[5][6]
Gewinnung und Darstellung |
Eisen(III)-phosphat kann durch Reaktion von Eisenhydroxid und Phosphorsäure oder aus Eisen(III)-chlorid und Dinatriumhydrogenphosphat[1] dargestellt werden
- FeCl3+Na2HPO4→FePO4↓+ 2 NaCl+HCl{displaystyle mathrm {FeCl_{3}+Na_{2}HPO_{4}rightarrow FePO_{4}downarrow + 2 NaCl+HCl} }
Verwendung |
Eisen(III)-phosphat wird als Wirkstoff in Pflanzenschutzmitteln (gegen Schnecken[7], also als Molluskizid), und in der Pharmazie, Nahrungsmittelindustrie und Keramik verwendet.
Werden Lithium-Eisenphosphat-Akkumulatoren vollständig geladen, so bestehen die Elektroden der Pluspolseite im Wesentlichen aus wasserfreiem Eisen(III)-phosphat FePO4. Dieses nimmt beim Entladen der Batterie Lithiumionen auf und wird dadurch in Lithiumeisenphosphat LiFePO4 umgewandelt:
- FePO4+Li++e−⟶LiFePO4+elektrische Energie{displaystyle mathrm {FePO_{4}+Li^{+}+e^{-}longrightarrow LiFePO_{4}} +{text{elektrische Energie}}}
Verwandte Verbindungen |
- Eisen(II)-phosphat
- Eisendiphosphat
- Eisen(III)-hydroxophosphat
Einzelnachweise |
↑ ab Heinrich Remy: Lehrbuch der Anorganischen Chemie Band II, Leipzig 1973, Seite 373.
↑ abc Eintrag zu CAS-Nr. 10045-86-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. August 2009 (JavaScript erforderlich).
↑ ab EU-Beurteilungsbericht Eisen(III)phosphat - Rechtliche Regelungen der Europäischen Union zu Pflanzenschutzmitteln und deren Wirkstoffen, Band D 33.
↑ Strengit (Mineralienatlas).
↑ Sanierung von Weihern und Seen (Memento des Originals vom 25. November 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.querbeet-freizeit.de
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.querbeet-freizeit.de
↑ Mikrobiell katalysierte Redoxreaktionen und Geochemie von Eisenverbindungen im Bodensee Sediment.
↑ Maßnahmen gegen die Schneckenplage (Umweltbundesamt).

